题目内容
19.下列各组离子在强酸性的溶液中能大量共存,且溶液无色透明的是( )| A. | Cu2+、Cl-、K+、SO42- | B. | CO32-、Na+、K+、SO42- | ||
| C. | Mg2+、Cl-、K+、NO3- | D. | Ag+、NO3-、K+、Cl- |
分析 强酸性溶液中存在电离氢离子,无色溶液中不存在有色的Cu2+、Fe2+、Fe3+等离子,
A.铜离子为有色离子;
B.碳酸根离子与氢离子反应;
C.四种离子之间不反应,都不与氢离子反应,且为无色溶液;
D.氯离子与银离子反应生成氯化银沉淀.
解答 解:强酸性溶液中存在电离氢离子,无色溶液中不存在有色的Cu2+、Fe2+、Fe3+等离子,
A.Cu2+为有色离子,不满足溶液无色的条件,故A错误;
B.CO32-与强酸性溶液中的氢离子反应,在溶液中不能大量共存,故B错误;
C.Mg2+、Cl-、K+、NO3-之间不反应,都是无色离子,且都不与强酸性溶液中的氢离子反应,在溶液中能够大量共存,故C正确;
D.Ag+、Cl-之间反应生成AgCl沉淀,在溶液中不能大量共存,故D错误;
故选C.
点评 本题考查了离子共存的判断,题目难度中等,注意熟练掌握离子反应发生条件,明确题干暗含信息的含义,如:强酸性溶液中存在电离氢离子,无色溶液中不存在有色离子等,试题培养了学生的灵活应用能力.

练习册系列答案
相关题目
9.下列物质,按其晶体的熔点由高到低顺序排列正确的是( )
| A. | SiO2 CsCl CBr4 CF4 | B. | SiO2 CsCl CF4 CBr4 | ||
| C. | CsCl SiO2 CBr4 CF4 | D. | CF4 CBr4 CsCl SiO2 |
7.25℃,有c(CH3COOH)+c(CH3COO-)=0.1mol•L-1的一组醋酸和醋酸钠混合溶液,溶液中c(CH3COOH)、c(CH3COO-)与pH值的关系如图所示.下列有关离子浓度关系叙述正确的是( )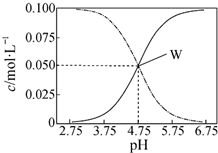

| A. | pH=5.5溶液中:c(CH3COOH)>c(CH3COO-)>c(H+)>c(OH-) | |
| B. | W点表示溶液中:c(Na+)═c(CH3COO-)+c(CH3COOH) | |
| C. | pH=3.5溶液中:c(Na+)+c(H+)-c(OH-)+c(CH3COOH)=0.1mol•L-1 | |
| D. | 向W点所表示的1.0L溶液中通入0.05molHCl气体(溶液体积变化可忽略):c(H+)═c(CH3COOH)+c(OH-) |
4.下列说法正确的是( )
| A. | 相同条件下,若1mol氢原子所具有的能量为E1,1mol氢分子具有的能量为E2,则2E1>E2 | |
| B. | 已知4A(g)+5B(g)?4C(g)+6D(g)△H<0,向平衡容器里继续加入A和B,△H会减小 | |
| C. | 浓硫酸用水稀释过程是放热的,所以稀释浓硫酸是一个放热反应. | |
| D. | 用铁片和稀硫酸反应制取氢气时,改用98%的浓硫酸可以加快产生氢气的速率 |
11.实验室制取氮气的一种方法是在实验装置中引发下列反应:NaNO2+NH4Cl=N2↑+NaCl+2H2O,反应开始时需要加热,然后停止加热反应仍能进行.下列关于该反应的说法正确的是( )
| A. | 该反应是放热反应 | |
| B. | 该反应是吸热反应 | |
| C. | 开始时该反应吸热,后来该反应放热 | |
| D. | 上述观点都不正确 |
8.已知:2KMnO4+16HCl=2MnCl2+2KCl+5Cl2↑+8H2O,则下列说法不正确的是( )
| A. | 还原剂是HCl,氧化剂是KMnO4 | |
| B. | 每生成1mol Cl2转移电子的物质的量为2mol | |
| C. | 氧化剂与还原剂的物质的量之比为1:8 | |
| D. | 氧化产物与还原产物的物质的量之比为5:2 |
9.能证明苯酚具有弱酸性的方法是( )
| A. | 苯酚浊液中加NaOH后,溶液变澄清 | |
| B. | 苯酚钠溶液中通入CO2后,溶液变浑浊 | |
| C. | 苯酚可与FeCl3溶液显紫色 | |
| D. | 在苯酚溶液中加入浓溴水产生白色沉淀 |