题目内容
9.能证明苯酚具有弱酸性的方法是( )| A. | 苯酚浊液中加NaOH后,溶液变澄清 | |
| B. | 苯酚钠溶液中通入CO2后,溶液变浑浊 | |
| C. | 苯酚可与FeCl3溶液显紫色 | |
| D. | 在苯酚溶液中加入浓溴水产生白色沉淀 |
分析 A.酸与碱发生中和反应无法确定酸电离的程度;
B.碳酸酸性强于苯酚,依据强酸制备弱酸原理判断;
C.苯酚与氯化铁溶液发生显色反应;
D.溴与苯酚发生取代反应,不能比较酸性强弱;
解答 解:A.苯酚的水溶液中加NaOH溶液,生成苯酚钠,只能说明苯酚溶液呈酸性,不能证明其为弱酸,故A错误;
B.依据强酸制备弱酸的原理,酚钠溶液中通入CO2后,生成苯酚与碳酸氢钠,溶液变浑浊,说明苯酚的酸性弱于碳酸,故B正确;
C.苯酚与氯化铁溶液发生显色反应,不能说明苯酚为弱酸,故C错误;
D.溴与苯酚发生取代反应,是溴原子取代苯酚苯环上的氢原子,不能比较酸性强弱,故D错误;
故选:B.
点评 本题考查了苯酚的性质,题目难度不大,熟悉苯酚的结构与性质是解题关键,注意强酸制备弱酸的规律.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
19.下列各组离子在强酸性的溶液中能大量共存,且溶液无色透明的是( )
| A. | Cu2+、Cl-、K+、SO42- | B. | CO32-、Na+、K+、SO42- | ||
| C. | Mg2+、Cl-、K+、NO3- | D. | Ag+、NO3-、K+、Cl- |
20.下列离子方程式书写正确的是( )
| A. | 钠与水反应:Na+2H2O═Na++OH-+H2↑ | |
| B. | 铁与硫酸铜溶液反应:Fe+Cu2+═Fe2++Cu | |
| C. | 碳酸钙与盐酸反应:CO32-+2H+═CO2↑+H2O | |
| D. | 氢氧化钡溶液与稀硫酸反应:Ba2++SO42-═BaSO4↓ |
17.设NA为阿伏加德罗常数的值,下列有关叙述不正确的是( )
| A. | 28g乙烯所含共用电子对数目为4NA | |
| B. | 1 mol甲基(-CH3)所含的电子总数为9NA | |
| C. | 0.5 mol1,3-丁二烯分子中含有C=C双键数为NA | |
| D. | 标准状况下,11.2 L己烷所含分子数为0.5 NA |
4.某核素的质量数为A,其阴离子Xn-核外有x个电子.有关该微粒的描述正确的是( )
| A. | Xn-的原子核内一定有(A-x-n)个中子 | |
| B. | Xn-的原子核内一定有(x-n)个质子 | |
| C. | Xn-的最外层一定具有8电子稳定结构 | |
| D. | Xn-的次外层一定排布了8个电子 |
14.下列分子中的所有原子一定在同一平面上的是( )
| A. |  | B. |  | C. |  | D. |  |
1. 乙苯催化脱氢制苯乙烯反应:
乙苯催化脱氢制苯乙烯反应:
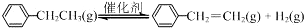
(1)已知:
计算上述反应的△H=+124 kJ•mol-1.
(2)维持体系总压强p恒定,在温度T时,物质的量为n、体积为V的乙苯蒸汽发生催化脱氢反应.已知乙苯的平衡转化率为α,则在该温度下反应的平衡常数K=$\frac{n{α}^{2}}{(1-{α}^{2})V}$(用α等符号表示).
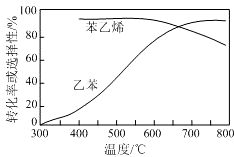
(3)工业上,通常在乙苯蒸气中掺混水蒸气(原料气中乙苯和水蒸气的物质的量之比为1:9),控制反应温度 600℃,并保持体系总压为常压的条件下进行反应.在不同反应温度下,乙苯的平衡转化率和某催化剂作用下苯乙烯的选择性(指除了H2以外的产物中苯乙烯的物质的量分数)示意图如下:
①掺入水蒸气能提高乙苯的平衡转化率,解释说明该事实正反应为气体分子数增大的反应,保持压强不变,加入水蒸气,容器体积应增大,等效为降低压强,平衡向正反应方向移动.
②控制反应温度为 600℃的理由是600℃时,乙苯的转化率和苯乙烯的选择性均较高.温度过低,反应速率慢,转化率低;温度过高,选择性下降.高温还可能使催化剂失活,且能耗大.
(4)某研究机构用CO2代替水蒸气开发了绿色化学合成工艺--乙苯-二氧化碳耦合催化脱氢制苯乙烯.保持常压和原料气比例不变,与掺水蒸汽工艺相比,在相同的生产效率下,可降低操作温度;该工艺中还能够发生反应:CO2+H2=CO+H2O,CO2+C=2CO.新工艺的特点有①②③④(填编号).
①CO2与H2反应,使乙苯脱氢反应的化学平衡右移
②不用高温水蒸气,可降低能量消耗
③有利于减少积炭
④有利于CO2资源利用.
 乙苯催化脱氢制苯乙烯反应:
乙苯催化脱氢制苯乙烯反应: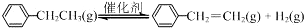
(1)已知:
| 化学键 | C-H | C-C | C=C | H-H |
| 键能/kJ•mol?1 | 412 | 348 | 612 | 436 |
(2)维持体系总压强p恒定,在温度T时,物质的量为n、体积为V的乙苯蒸汽发生催化脱氢反应.已知乙苯的平衡转化率为α,则在该温度下反应的平衡常数K=$\frac{n{α}^{2}}{(1-{α}^{2})V}$(用α等符号表示).
(3)工业上,通常在乙苯蒸气中掺混水蒸气(原料气中乙苯和水蒸气的物质的量之比为1:9),控制反应温度 600℃,并保持体系总压为常压的条件下进行反应.在不同反应温度下,乙苯的平衡转化率和某催化剂作用下苯乙烯的选择性(指除了H2以外的产物中苯乙烯的物质的量分数)示意图如下:
①掺入水蒸气能提高乙苯的平衡转化率,解释说明该事实正反应为气体分子数增大的反应,保持压强不变,加入水蒸气,容器体积应增大,等效为降低压强,平衡向正反应方向移动.
②控制反应温度为 600℃的理由是600℃时,乙苯的转化率和苯乙烯的选择性均较高.温度过低,反应速率慢,转化率低;温度过高,选择性下降.高温还可能使催化剂失活,且能耗大.
(4)某研究机构用CO2代替水蒸气开发了绿色化学合成工艺--乙苯-二氧化碳耦合催化脱氢制苯乙烯.保持常压和原料气比例不变,与掺水蒸汽工艺相比,在相同的生产效率下,可降低操作温度;该工艺中还能够发生反应:CO2+H2=CO+H2O,CO2+C=2CO.新工艺的特点有①②③④(填编号).
①CO2与H2反应,使乙苯脱氢反应的化学平衡右移
②不用高温水蒸气,可降低能量消耗
③有利于减少积炭
④有利于CO2资源利用.
19.填写溴、碘在不同溶剂中的颜色
| 水 | CCl4 | 汽油(苯) | |
| Cl2 | 黄绿色 | 黄绿色 | 黄绿色 |
| Br2 | 橙红色 | ||
| I2 | 紫红色 |
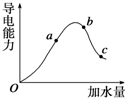 在25℃时,冰醋酸加水稀释过程中溶液的导电能力变化曲线如图所示,请回答:
在25℃时,冰醋酸加水稀释过程中溶液的导电能力变化曲线如图所示,请回答: