题目内容
7.25℃,有c(CH3COOH)+c(CH3COO-)=0.1mol•L-1的一组醋酸和醋酸钠混合溶液,溶液中c(CH3COOH)、c(CH3COO-)与pH值的关系如图所示.下列有关离子浓度关系叙述正确的是( )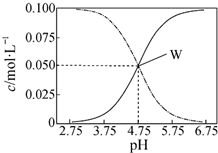
| A. | pH=5.5溶液中:c(CH3COOH)>c(CH3COO-)>c(H+)>c(OH-) | |
| B. | W点表示溶液中:c(Na+)═c(CH3COO-)+c(CH3COOH) | |
| C. | pH=3.5溶液中:c(Na+)+c(H+)-c(OH-)+c(CH3COOH)=0.1mol•L-1 | |
| D. | 向W点所表示的1.0L溶液中通入0.05molHCl气体(溶液体积变化可忽略):c(H+)═c(CH3COOH)+c(OH-) |
分析 A.醋酸、醋酸钠混合溶液,由图可知,溶液显酸性,则开始电离大于水解,W点c(CH3COO-)=c(CH3COOH),W点后,水解大于电离,c(CH3COO-)<c(CH3COOH);
B.由图可知,W点所表示的溶液中c(CH3COOH)=c(CH3COO-)=0.05mol/L,根据W点溶液的pH进行判断;
C.由电荷守恒及c(CH3COOH)+c(CH3COO-)=0.1mol•L-1分析;
D.W点为等量的醋酸和醋酸钠的混合液,溶液中通入0.05 mol HCl气体后,溶液呈电中性,根据物料守恒和电荷守恒判断.
解答 解:A.由图可知,pH=5.5 的溶液,显酸性,且c(CH3COO-)<c(CH3COOH),显性离子大于隐性离子,则c(CH3COOH)>c(CH3COO-)>c(H+)>c(OH-),故A正确;
B.溶液存在电荷守恒,应为c(Na+)+c(H+)=c(CH3COO-)+c(OH-),W点时c(CH3COOH)=c(CH3COO-),而氢离子浓度较小,则c(H+)<<c(CH3COOH),故c(Na+)+c(H+)<c(CH3COO-)+c(CH3COOH),故B错误;
C.由电荷守恒及c(CH3COOH)+c(CH3COO-)=0.1mol•L-1可知,c(Na+)+c(H+)-c(OH-)+c(CH3COOH)=c(CH3COO-)+c(CH3COOH)=0.1mol/L,故C正确;
D.向W点所表示溶液中通入0.05molHCl气体,原有平衡被打破,建立起了新的平衡,溶液中电荷守恒关系为:c(Na+)+c(H+)=c(CH3COO-)+c(OH-)+c(Cl-);物料守恒关系为:2c(Cl-)=c(CH3COO-)+c(CH3COOH)=0.1mol•L-1,得2c(Na+)+2c(H+)=3c(CH3COO-)+2c(OH-)+c(CH3COOH)
,c(Na+)=0.05mol/L,c(CH3COOH)+c(CH3COO-)=0.1mol/L,所以得c(H+)═c(CH3COO-)+c(OH-),故D错误;
故选AC.
点评 本题考查离子浓度大小比较,为高频考点,溶液中存在水解与电离两个过程的离子浓度大小比较似乎是考试热点内容,再结合守恒思想分析解答,题目难度不大.

 计算高手系列答案
计算高手系列答案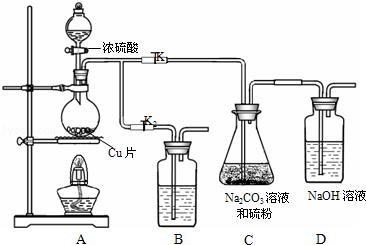
已知:Na2S2O3在酸性溶液中不能稳定存在.
(1)某研究小组设计了制备Na2S2O3•5H2O的装置和部分操作步骤如下.
步骤1:如图连接后装置后,打开K1,关闭K2,将D中导管末端浸入水中,微热烧瓶观察气泡和水柱,检查装置A、C、D气密性;
步骤2:加入药品,打开K1,关闭K2,向圆底烧瓶中加入足量浓硫酸,加热;
装置B中的药品可选用下列物质中的AC
A.NaOH溶液 B.浓H2SO4 C.酸性KMnO4溶液 D饱和NaHSO3溶液
步骤3:C中的混合液被气流搅动,反应一段时间后,硫粉的量逐渐减少.当C中溶液的pH接近7时打开K2,关闭K1即停止C中的反应,停止加热.“当C中溶液的pH接近7时即停止C中的反应”的原因是S2O32-+2H+═S↓+H2O+SO2↑.(用离子方程式表示)
步骤4:过滤C中的混合液,将滤液经过加热浓缩,趁热过滤,再将滤液冷却结晶、过滤、洗涤、烘干,得到产品
(2)Na2S2O3性质的检验,向足量的新制氯水中滴加少量的Na2S2O3溶液,氯水颜色变浅,检查反应后的溶液中有硫酸根,写出该反应的离子方程式S2O32-+4Cl2+5H2O=2SO42-+8Cl-+10H+;
(3)常用Na2S2O3溶液测定废水中Ba2+浓度,步骤如下:取废水25.00mL,控制适当的酸度加入足量K2Cr2O7溶液,得BaCrO4沉淀;过滤、洗涤后,用适量稀盐酸溶解.此时CrO42-全部转化为Cr2O72-;再加过量KI溶液,充分反应后,得到混合溶液Vml,将其分成4等分,加入淀粉溶液作指示剂,用0.010mol•L-1的Na2S2O3溶液进行滴定,相关数据如表所示
| 编 号 | 1 | 2 | 3 | 4 |
| 消耗Na2S2O3标准溶液的体积/mL | 18.02 | 17.98 | 18.00 | 20.03 |
判断达到滴定终点的现象是当滴入最后一滴Na2S2O3时,溶液蓝色消失且半分钟不变色.
废水中Ba2+的物质的量浓度为0.0024mol/L.
| A. | 在中毒过程中血红蛋白被氧化 | B. | 解毒时血红蛋白被还原 | ||
| C. | 维生素C应具有还原性 | D. | 中毒时亚硝酸盐发生氧化反应 |
| A. | Cu2+、Cl-、K+、SO42- | B. | CO32-、Na+、K+、SO42- | ||
| C. | Mg2+、Cl-、K+、NO3- | D. | Ag+、NO3-、K+、Cl- |
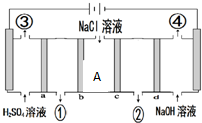
| A. | a和c为阳离子交换膜,b和d为阴离子交换膜 | |
| B. | ③与④两种气体体积比为1:1 | |
| C. | ①处生成的物质为氢氧化钠 | |
| D. | 当转移2mol e-时,A处减少离子数为2NA |
| A. | 28g乙烯所含共用电子对数目为4NA | |
| B. | 1 mol甲基(-CH3)所含的电子总数为9NA | |
| C. | 0.5 mol1,3-丁二烯分子中含有C=C双键数为NA | |
| D. | 标准状况下,11.2 L己烷所含分子数为0.5 NA |
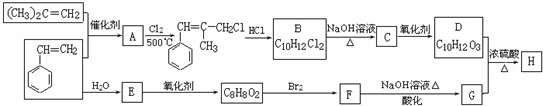
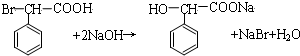 .
.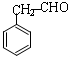 .
.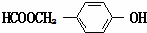 (写结构简式).
(写结构简式).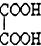
 目前城市空气质量恶化原因之一是机动车尾气和燃煤产生的烟气.NO和CO均为汽车尾气的成分,这两种气体在催化转换器中发生如下反应:
目前城市空气质量恶化原因之一是机动车尾气和燃煤产生的烟气.NO和CO均为汽车尾气的成分,这两种气体在催化转换器中发生如下反应: