题目内容
9.实验室欲用NaOH固体配制1.0mol•L-1的NaOH溶液240mL:(1)配制溶液时,一般可以分为以下几个步骤:
①称量 ②计算 ③溶解 ④倒转摇匀 ⑤转移 ⑥洗涤 ⑦定容 ⑧冷却
其正确的操作顺序为②①③⑧⑤⑥⑦④.本实验必须用到的仪器有天平、药匙、玻璃棒、烧杯、胶头滴管、还有250 mL容量瓶.
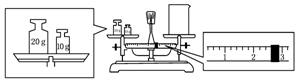
(2)某同学欲称量一定量的NaOH固体,他先用托盘天平称量烧杯的质量,天平平衡后的状态如图.烧杯的实际质量为27.4 g,要完成本实验该同学应称出10.0 g NaOH.
(3)使用容量瓶前必须进行的一步操作是检查容量瓶是否漏水.
分析 (1)根据实验操作的步骤以及每步操作需要仪器确定反应所需仪器;
(2)根据天平的称量原理;根据m=nM=cvM计算溶质NaOH的质量;
(3)使用容量瓶前必须进行的一步操作是检漏.
解答 解:(1)配制步骤有计算、称量、溶解、冷却、移液、洗涤、定容、摇匀等操作,一般用托盘天平称量,用药匙取用药品,在烧杯中溶解,冷却后转移到250mL容量瓶中,并用玻璃棒引流,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,所以需要的仪器为:托盘天平、药匙、烧杯、玻璃棒、250mL容量瓶、胶头滴管,
故答案为:②①③⑧⑤⑥⑦④;250mL容量瓶;
(2)因天平的称量原理:左盘物体的质量=右盘物体的质量+游码的读数,所以烧杯的实际质量为30g-2.6g=27.4g,因配制溶液的体积为240ml,而容量瓶的规格没有240ml,只能选用250ml,NaOH的质量m=cvM=1.0mol•L-1×0.25L×40g/mol=10.0g;
故答案为:27.4;10.0;
(3)因使用容量瓶前必须进行的一步操作是检查容量瓶是否漏水,
故答案为:检查容量瓶是否漏水.
点评 本题考查了一定物质的量浓度溶液的配制以及误差分析,难度不大,注意实验的基本操作方法和注意事项.

练习册系列答案
相关题目
9.2SO2(g)+O2(g)$?_{△}^{V_{2}O_{5}}$2SO3(g)是制备硫酸的重要反应.下列叙述正确的是( )
| A. | 催化剂V2O5不改变该反应的逆反应速率 | |
| B. | 增大压强,反应速率一定增大 | |
| C. | 该反应是放热反应,降低温度将缩短反应达到平衡的时间 | |
| D. | 在t1、t2时刻,SO3(g)的浓度分别是c1、c2(c1<c2),则时间间隔为 t1~t2内(t1<t2,以秒为单位),SO3(g)生成的平均速率为v=$\frac{({c}_{2}-{c}_{1})}{({t}_{2}-{t}_{1})}$ mol•L-1•s-1 |
10.下列说法不正确的是( )
| A. | CH3CH=CHCH3,分子中的四个碳原子在同一直线上 | |
| B. | 乙醛能使溴水出现褪色觋象,是因为乙醛发生了氧化反应 | |
| C. | 在酸性条件下,CH3CO18OCH2CH3的水解产物是CH3COOH和CH3CH218OH | |
| D. | 聚合物(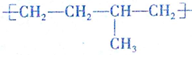 )可由单体CH3CH=CH2和CH2=CH2加聚制得 )可由单体CH3CH=CH2和CH2=CH2加聚制得 |
7.1.76克铜镁合金完全溶解于50mL、密度为1.40g/cm3、质量分数为63%的浓硝酸中,得到NO2 气体1792mL (标准状况),向反应后的溶液中加入适量的1.0mol/LNaOH溶液,恰使溶液中的金属离子全部沉淀.下列说法不正确的是( )
| A. | 该浓硝酸中HNO3的物质的量浓度是14.0mol/L | |
| B. | 加入NaOH溶液的体积是50mL | |
| C. | 浓硝酸在与合金反应中起了酸性和氧化性的双重作用 | |
| D. | 得到的金属氢氧化物的沉淀为3.12克 |
19.下列冶炼金属的方法正确的是( )
| A. | 电解MgO制取Mg | |
| B. | 加热条件下用CO还原Ag2O制取Ag | |
| C. | 在A1和F2O3反应中,生成11.2gFe,转移电子数为0.6NA | |
| D. | 电解NaCl溶液制取Na |