题目内容
18.在花瓶中加入“鲜花保鲜剂”,能延长鲜花的寿命.表是500mL“鲜花保鲜剂”中含有的成分,阅读并回答下列问题:| 成分 | 成分的质量(g) | 摩尔质量(g•mol-1) |
| 蔗糖 | 25.00 | 342 |
| 硫酸钾 | 0.87 | 174 |
| 阿司匹林 | 0.17 | 180 |
| 高锰酸钾 | 0.316 | 158 |
| 硝酸银 | 0.02 | 170 |
(2)配制上述“鲜花保鲜剂”所的仪器有烧杯、玻璃棒、药匙、托盘天平(带砝码)、500mL容量瓶、胶头滴管(填所缺仪器的名称).
(3)在溶液配制过程中,下列操作对配制结果没有影响的是BD.
A.定容时,俯视容量瓶刻度线
B.容量瓶在使用前未干燥,里面有少量蒸馏水
C.容量瓶在使用前刚刚配制完一定物质的量浓度的NaCl溶液而未洗净
D.定容摇匀后发现液面低于容量瓶的刻度线,但未做任何处理
(4)若要配制0.5mol/L 500mL的硫酸溶液,则:
①所需质量分数为98%、密度为1.84g.cm-3的浓硫酸的体积为13.6(计算结果保留一位小数)mL;
②如果实验室有15mL、20mL、50mL量筒,应选用15mL量筒最好;
③配制过程中需先在烧杯中将浓硫酸稀释,稀释时操作方法是将浓硫酸沿烧杯壁注入水中并用玻 璃棒不断搅拌.
分析 (1)K+来自高锰酸钾、硫酸钾的电离,由n=$\frac{m}{M}$计算高锰酸钾、硫酸钾的物质的量及所含钾离子的物质的量,依据C=$\frac{n}{V}$计算;
(2)根据配制溶液的实验操作过程进行实验步骤排序;
(3)分析操作对溶质的物质的量或对溶液的体积的影响,根据c=$\frac{n}{V}$分析判断;
(4)①依据C=$\frac{1000ρω}{M}$计算浓硫酸的物质的量浓度,溶液稀释过程中溶质的物质的量不变,据此计算需要浓硫酸体积;
②依据浓硫酸体积选择合适规格量筒;
③依据浓硫酸稀释的正确操作解答;
解答 解:(1)高锰酸钾的物质的量为n(KMnO4)=$\frac{0.316g}{158g/mol}$=0.002mol;
硫酸钾的物质的量为n(K2SO4)=$\frac{0.87g}{174g/mol}$=0.005mol,
n(K+)=n(KMnO4)+2n(K2SO4)=0.002mol+2×0.005mol=0.012mol,所以c(K+)=$\frac{0.012mol}{0.5L}$=0.024mol/L;
故答案为:0.024mol/L;
(2)操作步骤有计算、称量、溶解、移液、洗涤移液、定容、摇匀等操作,一般用托盘天平称量,用药匙取用药品,在烧杯中溶解(可用量筒量取水加入烧杯),并用玻璃棒搅拌,加速溶解.冷却后转移到500mL容量瓶中,并用玻璃棒引流,洗涤烧杯、玻璃棒2-3次,并将洗涤液移入容量瓶中,加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,最后定容颠倒摇匀,
所以需仪器有:托盘天平、烧杯、玻璃棒、药匙外、500mL容量瓶、胶头滴管、量筒(可用可不用)等,
故答案为:500mL容量瓶;胶头滴管;
(3)A.定容时,俯视容量瓶刻度线,导致溶液体积偏小,溶液浓度偏高,故A不选;
B.容量瓶在使用前未干燥,里面有少量蒸馏水,对溶质的物质的量和溶液体积都不产生影响,溶液浓度不变,故B选;
C.容量瓶在使用前刚刚配制完一定物质的量浓度的NaCl溶液而未洗净,氯化钠能够与硝酸银反应,导致溶质的物质的量偏小,产生误差,故C不选;
D.定容摇匀后发现液面低于容量瓶的刻度线,但未做任何处理,属于正确操作,溶液浓度准确,故D选;
故选:BD;
(4)①质量分数为98%、密度为1.84g.cm-3的浓硫酸,物质的量浓度C=$\frac{1000×1.84×98%}{98}$=18.4mol/L,配制0.5mol/L 500mL的硫酸溶液设需要浓硫酸体积为V,则依据溶液稀释过程中溶质的物质的量不变得:V×18.4mol/L=0.5mol/L×500mL,解得V=13.6mL;
故答案为:13.6;
②量取13.6mL溶液,应选择15mL量筒;
故答案为:15;
③浓硫酸稀释的正确操作为:将浓硫酸沿烧杯壁注入水中并用玻 璃棒不断搅拌;
故答案为:将浓硫酸沿烧杯壁注入水中并用玻 璃棒不断搅拌.
点评 本题考查了一定物质的量浓度溶液的配制,明确配制原理及操作步骤是解题关键,题目难度不大.

 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案| A. | 当温度一定时,不同的起始条件下可逆反应建立平衡状态时,平衡常数和转化率一定是定值 | |
| B. | 依据焓判据:NH4HCO3受热分解可自发进行 | |
| C. | 大多数化学反应在一定条件下都有一定的限度 | |
| D. | FeCl3与KSCN反应达到平衡时,向其中滴加少量KCl溶液,则溶液颜色变深 |
| A. | 蒸发操作时,应使混合物中的水分完全蒸干后,才能停止加热 | |
| B. | 蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处 | |
| C. | 分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 | |
| D. | 萃取操作时,应选择有机萃取剂,萃取剂的密度不一定比水大 |
| A. | 200mL 2 mol/LMgCl2溶液 | B. | 1000mL 2.5 mol/L NaCl溶液 | ||
| C. | 300mL 5 mol/L KCl溶液 | D. | 250mL 1 mol/L FeCl3溶液 |
| 组别 | c(一元酸) | c(NaOH)/mol•L-1 | 混合溶液的pH |
| 甲 | c(HX)=0.1mol•L-1 | 0.1 | pH=x |
| 乙 | c(HY)=0.1mol•L-1 | 0.1 | pH=7 |
| 丙 | c(HZ)=0.1mol•L-1 | 0.1 | pH=9 |
(2)部分实验反应过程中的pH变化曲线如图:

①表示乙组实验的pH变化曲线是图1(填“图1”或“图2”)
②以上两图中表示溶液恰好完全反应的点是BE.
(3)常温下,将pH=3的盐酸aL分别与下列三种溶液混合,所得溶液均呈中性.
①浓度为1.0×10-3 mol•L-1的氨水b L
②c(OH-)=1.0×10-3 mol•L-1的氨水c L
③c(OH-)=1.0×10-3 mol•L-1的氢氧化钡溶液d L.则a、b、c、d的大小关系是b>a=d>c.
(4)常温下,取pH=2的盐酸和醋酸溶液各100mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如图所示.则图3中表示醋酸溶液中pH变化曲线的是B(填“A”或“B”);设盐酸中加入的Zn质量为m1,醋酸溶液中加入的Zn质量为m2.则m1 <m2(填“<”、“=”、“>”)
| A. | 冰毒、黄连素 | B. | 海洛因、冰毒 | C. | 大麻、摇头丸 | D. | 黄曲霉素、尼古丁 |
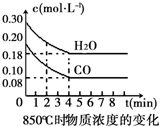 在一体积为10L的容器中,通入一定量的CO和H2O(g),在850℃时发生如下反应:CO(g)+H2O(g)?CO2(g)+H2(g).CO和H2O(g)浓度变化如图
在一体积为10L的容器中,通入一定量的CO和H2O(g),在850℃时发生如下反应:CO(g)+H2O(g)?CO2(g)+H2(g).CO和H2O(g)浓度变化如图(1)0~4min的平均反应速率v(CO)=0.03mol•L-1•min-1.
(2)该条件下,此反应的平衡常数K=$\frac{c(C{O}_{2})×c({H}_{2})}{c(CO)c({H}_{2}O)}$(写表达式).
(3)该反应平衡时CO的转化率为60%.
(4)能判断该反应达到化学平衡状态的依据是BC.
A.容器中压强不变 B.混合气体中c(CO)不变
C.v(H2)正=v(H2O)逆 D.c(CO2)=c(CO)
若降低温度,该反应的K值将增大,该反应的化学反应速率将减小(填“增大”“减小”或“不变”).
(5)t℃(高于850℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如表.
| 时间(min) | CO | H2O | CO2 | H2 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0J062 |
| 3 | c1 | c2 | c3 | c3 |
| 4 | c1 | c2 | c3 | c3 |
| 5 | 0.116 | 0216 | 0.084 | |
| 6 | 0.096 | 0.266 | 0.104 |
②反应在4min~5min间,平衡向逆方向移动,可能的原因是D,表中5min~6min之间数值发生变化,可能的原因是A.
a.增加水蒸气 b.降低温度 c.使用催化剂 d.增加氢气浓度.
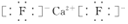 ;Y2与NaOH溶液反应的产物之一是OY2,该反应的离子方程式为2F2+2OH-=OF2↑+2F-+H2O.
;Y2与NaOH溶液反应的产物之一是OY2,该反应的离子方程式为2F2+2OH-=OF2↑+2F-+H2O.