题目内容
20.已知热化学方程式:H2O(g)═H2(g)+O2(g)△H=+241.8kJ•mol -1
H2(g)+O2(g)═H2O(1)△H=-285.8kJ•mol -1
当1g液态水变为水蒸气时,其热量变化是( )
| A. | 吸热88kJ | B. | 吸热2.44 kJ | C. | 放热44kJ | D. | 吸热44 kJ |
分析 ①H2O(g)═H2(g)+O2(g)△H=+241.8kJ•mol-1,②H2(g)+O2(g)═H2O(1)△H=-285.8kJ•mol-1,根据盖斯定律,①+②可得:H2O(g)═H2O(1)△H=-44kJ•mol-1,则:H2O(1)=H2O(g)△H=+44kJ•mol-1,即:18g液态水变成水蒸气吸收44kJ热量,据此计算出1g液态水变为水蒸气吸收的热量.
解答 解:①H2O(g)═H2(g)+O2(g)△H=+241.8kJ•mol-1
②H2(g)+O2(g)═H2O(1)△H=-285.8kJ•mol-1,
根据盖斯定律,①+②可得:H2O(g)═H2O(1)△H=-44kJ•mol-1,
则:H2O(1)=H2O(g)△H=+44kJ•mol-1,即:18g液态水变成水蒸气吸收44kJ热量,
所以1g液态水变成水蒸气吸收的热量为:$\frac{44kJ}{18}$≈2.44kJ,
故选B.
点评 本题考查了热化学方程式的计算,题目难度中等,明确盖斯定律的内容为解答关键,注意掌握热化学方程式与焓变的关系是,试题培养了学生的化学计算能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
10.下列离子方程式书写正确的是( )
| A. | Ba(OH)2溶液与少量的NaHCO3溶液混合:Ba2++2OH-+2HCO3-═BaCO3↓+CO32-+2H2O | |
| B. | 次氯酸钙溶液中通入少量SO2气体:Ca2++2ClO-+SO2+H2O═CaSO3↓+2HClO | |
| C. | 金属钠与水反应:2Na+2 H2O═2Na++2 OH-+H2↑ | |
| D. | 醋酸与氢氧化钠溶液的反应:H++OH-═H2O |
11.下列元素中金属性最强的是( )
| A. | K | B. | Na | C. | Cs | D. | Si |
15.下列说法中不正确的是( )
| A. | 原子及其离子的核外电子层数等于该元素所在的周期数 | |
| B. | 元素周期表中从ⅢB族到ⅡB族之间的10个纵行的元素都是金属元素 | |
| C. | 非极性键也可能存在于离子化合物中 | |
| D. | 双原子分子中的共价键,可能是极性键 |
5.用NA表示阿伏加德罗常数,下列叙述正确的是( )
| A. | 100g质量分数是98%的浓硫酸中所含氧原子数为4NA | |
| B. | 标况下33.6mL氯气通入足量水中发生反应,转移电子数为1.5×10-3NA | |
| C. | 常温常压下,5.6g乙烯与丁烯的混合物中含有的氢原子数目为0.8 NA | |
| D. | 同温下,pH=1体积为1L的硫酸溶液所含氢离子数与pH=13体积为1L的氢氧化钠溶液所含氢氧根离子数均为0.1NA |
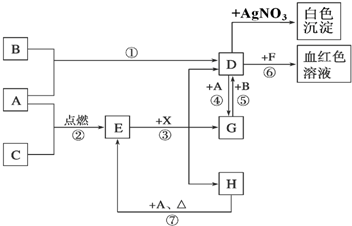
 .
.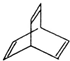 X与足量的H2在一定条件下反应可生成环状的饱和烃Z,Z的一氯代物有2种.
X与足量的H2在一定条件下反应可生成环状的饱和烃Z,Z的一氯代物有2种. .Y能使溴水褪色,其反应的化学方程式为
.Y能使溴水褪色,其反应的化学方程式为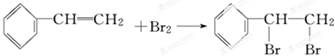 .Y可以用来合成一种聚合物---泡沫塑料,请写出该聚合物的结构简式
.Y可以用来合成一种聚合物---泡沫塑料,请写出该聚合物的结构简式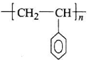 .有机化学中有多种同分异构现象,其中有顺反异构,请写出Y的侧链多一个甲基的有机物W的两种顺反异构的结构简式:
.有机化学中有多种同分异构现象,其中有顺反异构,请写出Y的侧链多一个甲基的有机物W的两种顺反异构的结构简式: ,
,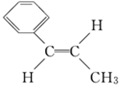 .
.