题目内容
15.下列说法中不正确的是( )| A. | 原子及其离子的核外电子层数等于该元素所在的周期数 | |
| B. | 元素周期表中从ⅢB族到ⅡB族之间的10个纵行的元素都是金属元素 | |
| C. | 非极性键也可能存在于离子化合物中 | |
| D. | 双原子分子中的共价键,可能是极性键 |
分析 A.阳离子的电子层数比原子的电子层数少1;
B.从ⅢB族到ⅡB族之间的10个纵行为副族和第ⅤⅢ族;
C.过氧化钠中含O-O非极性键,为离子化合物;
D.双原子分子中的共价键,如HCl中为极性共价键.
解答 解:A.阳离子的电子层数比原子的电子层数少1,而原子及其阴离子的核外电子层数等于该元素所在的周期数,故A错误;
B.从ⅢB族到ⅡB族之间的10个纵行为副族和第ⅤⅢ族,均为金属元素,故B正确;
C.过氧化钠中含O-O非极性键,为离子化合物,则非极性键也可能存在于离子化合物中,故C正确;
D.双原子分子中的共价键,如氢气中为非极性共价键、HCl中为极性共价键,则双原子分子中的共价键可能是极性键,故D正确;
故选A.
点评 本题考查周期表的结构及应用、化学键,为高频考点,把握元素的位置、性质及化学键的判断为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
 小学教材全测系列答案
小学教材全测系列答案 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案
相关题目
6.下列关于元素周期表的说法,错误的是( )
| A. | 元素周期表是元素按原子序数大小排列而成的 | |
| B. | 元素原子的电子层数等于其所在周期的周期序数 | |
| C. | 元素原子的最外层电子数等于其所在族的族序数 | |
| D. | 元素周期表中共有18列,16个族 |
20.已知热化学方程式:
H2O(g)═H2(g)+O2(g)△H=+241.8kJ•mol -1
H2(g)+O2(g)═H2O(1)△H=-285.8kJ•mol -1
当1g液态水变为水蒸气时,其热量变化是( )
H2O(g)═H2(g)+O2(g)△H=+241.8kJ•mol -1
H2(g)+O2(g)═H2O(1)△H=-285.8kJ•mol -1
当1g液态水变为水蒸气时,其热量变化是( )
| A. | 吸热88kJ | B. | 吸热2.44 kJ | C. | 放热44kJ | D. | 吸热44 kJ |
7.短周期元素X、Y、Z、W、M的原子序数依次增大,且原子最外层电子数之和为17,X与Y是组成化合物种类最多的元素,W是地壳中含量最高的元素.下列说法正确的是( )
| A. | 原子半径大小顺序:r(Y)>r(Z)>r(W)>r(M) | |
| B. | 由三种元素X、Z、W形成的化合物中只有共价键而无离子键 | |
| C. | Z的气态氢化物比W的气态氢化物更稳定 | |
| D. | 分子式为Y4X8W2的物质超过10种 |
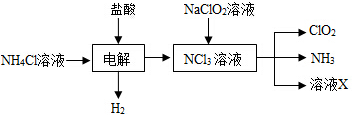
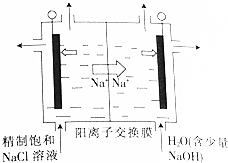
 .
.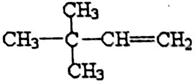 或
或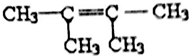 .
. 过硫酸:
过硫酸: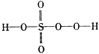
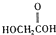 (b)
(b)  (c) H2O2 (d)
(c) H2O2 (d) 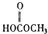
 (f)
(f)  (g) O2 (h)
(g) O2 (h) 
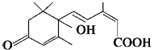 分子式为C15H20O4;
分子式为C15H20O4; 分子式C11H16
分子式C11H16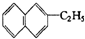 属于萘的同系物,则萘和萘的同系物分子组成通式CnH2n-12(n≥10)
属于萘的同系物,则萘和萘的同系物分子组成通式CnH2n-12(n≥10)
 .
.