题目内容
19.2NH3+CO2?NH2COONH4(s),此反应温度越低越容易自发进行,则该反应正向为放热反应(填“吸”或“放热”).若将一定量的NH2COONH4置于恒温密闭容器中,其分解达到平衡状态,此时容器内压强为P1,混合气体的密度为ρ1.缩小容器的容积,再次达平衡时,容器内压强为P2,混合气体的密度为ρ2.则P1<P2(填“>”“=”或“<”),ρ1<ρ2(填“>”“=”或“<”)
分析 2NH3+CO2?NH2COONH4(s),正反应方向混乱度减小,△S<0,根据△H-T•△S<0反应自发进行判断△H;缩小容器的容积可导致容器内的压强增大,平衡正向移动,但条件的改变大于平衡移动的改变.
解答 解:2NH3+CO2?NH2COONH4(s),正反应方向混乱度减小,△S<0,此反应温度越低越容易自发进行,说明在较低温度下△H-T•△S<0,△H<0,即为放热反应;缩小容器的容积可导致容器内的压强增大,因此P1<P2,虽然平衡正向移动,但条件的改变大于平衡移动的改变,因此气体的密度增大,即为ρ1<ρ2,
故答案为:放热;<;<.
点评 本题考查了化学平衡及化学反应进行的方向,难度不大,注意对勒夏特列原理的理解,条件的改变大于平衡移动的改变.

练习册系列答案
相关题目
9.有机物A的分子式为C5H10O2,其在氢氧化钠溶液中加热水解得B、C两种物质,已知B能与盐酸反应生成E,E能发生银镜反应,而C不能发生银镜反应.则A可能的结构有( )
| A. | 1种 | B. | 2种 | C. | 3种 | D. | 4种 |
7.下列化学用语书写正确的是( )
| A. | 四氯化碳的电子式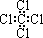 | B. | 环丙烷的最简式CH2 | ||
| C. | 甲醛的结构式HCHO | D. | S2-的最外层电子排布式3s23p4 |
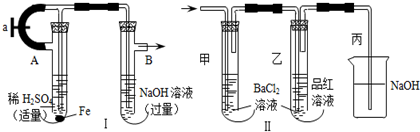
11.某实验小组按如表中的装置进行实验,已知电极A、B、C、D分别是Mg、Al、Cu、Ag中的一种,
根据实验现象回答下列问题:
(1)A、D分别为Al、Cu.
(2)乙装置中C电极的电极反应式为2H2O+2e-═H2↑+2OH-.
(3)上述实验证明了“利用金属活动性顺序可直接判断原电池的正负极”,这种做法不可靠(填“可靠”或“不可靠”)
| 装置 | 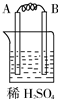 甲 甲 | 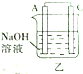 | 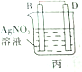 | 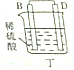 |
| 现象 | A不断溶解 | A极有气泡产生 | B电极质量增加 | B、D电极均无明显变化 |
(1)A、D分别为Al、Cu.
(2)乙装置中C电极的电极反应式为2H2O+2e-═H2↑+2OH-.
(3)上述实验证明了“利用金属活动性顺序可直接判断原电池的正负极”,这种做法不可靠(填“可靠”或“不可靠”)
 .
.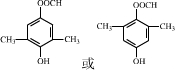 .
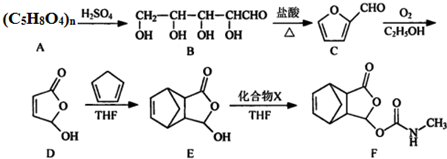
.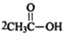 $\stackrel{P_{2}O_{3}}{→}$
$\stackrel{P_{2}O_{3}}{→}$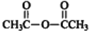 ,化合物
,化合物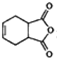 是合成抗病毒药阿普洛韦的中间体,请设计合理方案以
是合成抗病毒药阿普洛韦的中间体,请设计合理方案以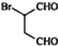 和
和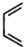 为原料合成该化合物(用合成路线流程图表示:并注明反应条件).合成路线流程图实力如下CH3CH2OH$→_{170℃}^{浓硫酸}$CH2═CH2$\stackrel{Br_{2}}{→}$
为原料合成该化合物(用合成路线流程图表示:并注明反应条件).合成路线流程图实力如下CH3CH2OH$→_{170℃}^{浓硫酸}$CH2═CH2$\stackrel{Br_{2}}{→}$
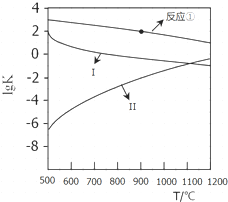 用CaSO4代替O2与燃料CO反应,既可提高燃烧效率,又能得到高纯CO2,是一种高效、清洁、经济的新型燃烧技术,反应①为主反应,反应②和③为副反应.
用CaSO4代替O2与燃料CO反应,既可提高燃烧效率,又能得到高纯CO2,是一种高效、清洁、经济的新型燃烧技术,反应①为主反应,反应②和③为副反应. .
.