题目内容
19.雾霾含有大量的污染物SO2、NO.工业上变“废”为宝,吸收工业尾气SO2和NO,可获得Na2S2O4和NH4NO3产品的流程图如图1(Ce为铈元素):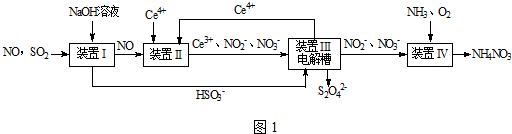
(1)装置Ⅰ中的主要离子方程式为SO2+OH-=HSO3-.
(2)含硫各微粒(H2SO3、HSO3-和SO32-)存在于SO2与NaOH溶液反应后的溶液中,它们的物质的量分数X(i)与溶液pH 的关系如图2所示.
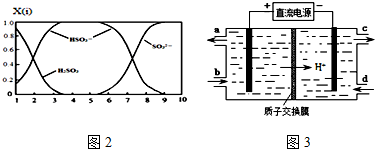
①若是0.1molNaOH反应后的溶液,测得溶液的pH=8时,溶液中各离子浓度由大到小的顺序是c(Na+)>c(SO32-)>c(HSO3-)>c(OH-)>c(H+).
②向pH=5的NaHSO3溶液中滴加一定浓度的CaCl2溶液,溶液中出现浑浊,pH降为2,用化学平衡移动原理解释溶液pH降低的原因:HSO3-在溶液中存在电离平衡:HSO3-?SO32-+H+,加CaCl2溶液后,Ca2++SO32-=CaSO3↓使电离平衡右移,c(H+)增大.
(3)写出装置Ⅱ中,酸性条件下的离子方程式NO+2H2O+3Ce4+=3Ce3++NO3-+4H+.
(4)装置Ⅲ还可以使Ce4+再生,其原理如图3所示.
①生成Ce4+从电解槽的a(填字母序号)口流出.
②写出与阴极的反应式2HSO3-+4H++4e-=S2O32-+3H2O.
(5)用铂电极A、B电解CuSO4溶液,先在A上收集到5.6L气体,然后反接电源,又在B极上收集到5.6L气体.整个过程中电路通过的电子为2mol.(气体体积均为标准状况下的体积)
分析 SO2、NO是大气污染物,通过氢氧化钠溶液吸收得到亚硫酸氢钠,一氧化氮不反应,通过装置Ⅱ加入Ce4+氧化还原反应得到Ce3+、NO2-、NO3-等,和亚硫酸氢钠混合,在电解池中通电电解得到Ce4+循环使用,获得Na2S2O4,NO2-、NO3-等加入氨气和氧气在装置Ⅳ中发生反应得到NH4NO3产品,
(1)二氧化硫是酸性氧化物,能和强碱之间发生反应;
(2)①当溶液的pH=8时,根据图示得到溶液是亚硫酸钠和亚硫酸氢钠的混合物,根据离子浓度大小比较的方法来回答;
②NaHSO3溶液中HSO3-的电离大于水解,溶液显示酸性,根据平衡移动原理来回答;
(3)在酸性环境下,NO和Ce4+之间会发生氧化还原反应;
(4)在电解池中,阳极上发失去电子的氧化反应,阴极上发生得电子的还原反应;
(5)电解CuSO4溶液,先在A上收集到5.6L即0.25mol气体,即为氧气,发生反应:4OH--4e-=2H2O+O2↑;A是阳极,B极上发生反应:Cu2++2e-=Cu,该电极析出金属铜,B是阴极,根据电子守恒计算生成金属铜的物质的量,然后电极反接,在B极上收集到5.6L气体即为氧气,此时B是阳极,先是金属铜失电子,然后是4OH--4e-=2H2O+O2↑,根据电子守恒计算即可.
解答 解:(1)二氧化硫是酸性氧化物,能和强碱氢氧化钠之间发生反应:SO2+OH-=HSO3-,NO和氢氧化钠之间不会反应,故答案为:SO2+OH-=HSO3-;
(2)①当溶液的pH=8时,根据图示得到溶液是亚硫酸钠和亚硫酸氢钠的混合物,离子浓度大小顺序是:c(Na+)>c(SO32-)>c(HSO3-)>c(OH-)>c(H+),
故答案为:c(Na+)>c(SO32-)>c(HSO3-)>c(OH-)>c(H+);
②NaHSO3溶液中HSO3-的电离大于水解,HSO3-?SO32-+H+,溶液显示酸性,加入CaCl2溶液后,Ca2++SO32-=CaSO3↓使电离平衡右移,
故答案为:HSO3-在溶液中存在电离平衡:HSO3-?SO32-+H+,加CaCl2溶液后,Ca2++SO32-=CaSO3↓使电离平衡右移,c(H+)增大;
(3)在酸性环境下,NO和Ce4+之间会发生氧化还原反应:NO+H2O+Ce4+=Ce3++NO2-+2H+,故答案为:NO+2H2O+3Ce4+=3Ce3++NO3-+4H+;
(4)①在电解池中,阳极上是Ce3+失电子成为Ce4+的过程,所以生成Ce4+从电解槽的阳极上极a极流出,故答案为:a;
②电解池的阴极发生得电子的还原反应,电极反应式为:2HSO3-+4H++4e-=S2O32-+3H2O,故答案为:2HSO3-+4H++4e-=S2O32-+3H2O;
(5)电解CuSO4溶液,先在A上收集到5.6L即0.25mol气体,即为氧气,发生反应:4OH--4e-=2H2O+O2↑;此时转移电子1mol,A是阳极,B极上发生反应:Cu2++2e-=Cu,该电极析出金属铜,B是阴极,根据电子守恒,转移1mol电子,生成金属铜的物质的量是0.5mol,然后电极反接,在B极上收集到5.6L气体即为氧气,此时B是阳极,先是金属铜失电子,发生反应:Cu-2e-=Cu2+,转移电子1mol,然后是4OH--4e-=2H2O+O2↑,收集到5.6L0.25mol气体转移电子1mol,所以转移电子是2mol,
故答案为:2.
点评 本题考查了电解原理、二氧化硫的污染及治理、化学平衡及其影响、氧化还原反应等知识,题目难度中等,试题知识点较多、综合性较强,充分考查学生的分析能力及灵活应用基础知识的能力,注意掌握电解原理、化学平衡移动原理及其应用,能够正确书写电极反应式、离子方程式.

 名校课堂系列答案
名校课堂系列答案| A. | x=10时,溶液中有NH4+、AlO2-、SO42-,且c(NH4+)>c(SO42-) | |
| B. | x=10时,溶液中有NH4+、Al3+、SO42-,且c(NH4+)>c(Al3+) | |
| C. | x=30时,溶液中有Ba2+、AlO2-、OH-,且c(OH-)<c(AlO2-) | |
| D. | x=30时,溶液中有Ba2+、Al3+、OH-,且c(OH-)=c(Ba2+) |
| A. | 常温下,10mL0.2mol/LNH4NO3溶液与10mL0.1mol/LNaOH溶液混合后所得pH=9.6的溶液中:c(NO3-)>c(NH4+)>c(Na+)>(NH3•H2O)>c(OH-)>c(H+) | |
| B. | 0.1mol•L-1Na2S溶液中:c(Na+)+c(H+)=c(S2-)+c(HS-)+c(OH-) | |
| C. | 室温下,Ka(CH3COOH)=Kb(NH3•H2O)=1.7×10-5,则CH3COOH溶液中c(H+)和NH3•H2O溶液中的c(OH-)相等 | |
| D. | 室温下,向0.10mol•L-1的氨水中加入少量NaOH,溶液中c(NH${\;}_{4}^{+}$)减小,Kw减小 |
| 元素编号 | 元素性质或原子结构 |
| T | 最外层电子占核外电子总数的3/8 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z | 元素最高正价是+7价 |
(2)Y的氢化物与Y的最高价氧化物的水化物反应生成的物质名称为:硝酸铵
(3)Z所在族元素的四种氢化物中,沸点最低的物质的化学式为:HCl
(4)探寻物质的性质差异性是学习的重要方法之一.T、X、Y、Z四种元素的最高价氧化物的水化物中化学性质明显不同于其他三种酸的是H2CO3(填分子式),阐述理由是碳酸为弱酸,其余三种酸为强酸.
| A. | 将AlCl3溶液与Na2S溶液混合 | B. | 将H2S气体通入Al2(SO4)3溶液中 | ||
| C. | 将Al(NO3)3固体与K2S固体混合 | D. | 将金属铝与硫混合加热 |
| A. |  | B. | 邻甲基苯酚 | C. |  | D. | 2-甲基2-己烯 |
| A. | Na2S溶液:c(Na+)>c(HS-)>c(OH-)>c(H2S) | |
| B. | Na2C2O4溶液:c(OH-)=c(H+)+c(HC2O4-)+c(H2C2O4) | |
| C. | Na2CO3溶液:c(Na+)+c(H+)=2c(CO32-)+c(OH-) | |
| D. | CH3COONa和CaCl2混合溶液:c(Na+)+c(Ca2+)=c(CH3COO-)+c(CH3COOH)+2c(Cl-) |
| A. | 等体积硫酸铁、硫酸铜、硫酸钾溶液分别与足量的氯化钡溶液反应,若生成的硫酸钡沉淀的质量比为1:2:3,则三种硫酸盐溶液的物质的量浓度比为1:2:3 | |
| B. | 150 mL 1mol•L-1的氯化钾溶液中的c(Cl-)与50 mL 1 mol•L-1的氯化铝溶液中的c(Cl-)相等 | |
| C. | 20℃时,饱和KCl溶液的密度为1.174g•cm-3,物质的量浓度为4.0 mol•L-1,则此溶液中KCl的质量分数为$\frac{74.5×4.0}{1.174×1000}$×100% | |
| D. | 20℃时,100 g水可溶解34.2g KCl,此时KCl饱和溶液的质量分数为34.2% |
| A. | 将水加热,平衡向正反应方向移动,Kw不变 | |
| B. | 向水中加入少量NaOH固体,平衡向逆反应方向移动,c(OH-)降低 | |
| C. | 向水中加入少量盐酸,平衡向逆反应方向移动,c(H+)增大 | |
| D. | 向水中加入少量CH3COONa固体,平衡向正反应方向移动,c(OH-)═c(H+) |