题目内容
6.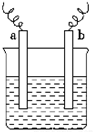 如图中,两电极上发生的电极反应如下:a极:Cu2++2e-═Cu;b极:Fe-2e-═Fe2+,则以下说法中不正确的是( )
如图中,两电极上发生的电极反应如下:a极:Cu2++2e-═Cu;b极:Fe-2e-═Fe2+,则以下说法中不正确的是( )| A. | 该装置一定是原电池 | |
| B. | a极上一定发生还原反应 | |
| C. | a、b可以是同种电极材料 | |
| D. | 该过程中能量的转换可以是电能转化为化学能 |
分析 由电极方程式可知,Cu2+被还原,可为原电池正极反应或电解池阴极反应,Fe被氧化,可为原电池负极反应或电解池阳极反应,以此解答该题.
解答 解:A.可能为电解池,a极发生还原反应,为阴极,b极发生氧化反应,为阳极,电解质可为硫酸铜溶液,故A错误;
B.a电极发生Cu2+得电子被还原,一定发生还原反应,故B正确;
C.如a、b都为铁片,电解质溶液为硫酸铜,电解可发生题中反应,故C正确;
D.装置可为电解池,该过程中能量的转换可以是电能转化为化学能,故D正确.
故选A.
点评 本题考查原电池和电解池知识,侧重于学生的分析能力和电化学知识的综合考查,为高考常见题型和高频考点,注意根据电极方程式判断,难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
17.在含有Fe3+、Fe2+、Al3+、Cl-的稀溶液中,加入足量的Na2O2固体并微热,充分反应后,再加入过量的稀盐酸,完全反应后,离子数目没有明显变化的是( )
| A. | Fe3+ | B. | Fe2+ | C. | Al3+ | D. | Cl- |
11.下列说法正确的是( )
| A. | BaSO4难溶于水,但BaSO4是电解质 | |
| B. | 铜和石墨均能导电,所以它们都是电解质 | |
| C. | 电解质一定能导电,能导电的物质不一定属于电解质 | |
| D. | 液态HCl不导电,所以HCl不是电解质 |
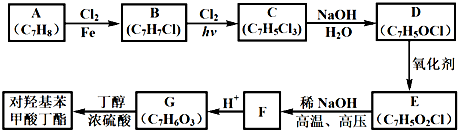
 .
.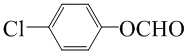 (写一种结构简式)
(写一种结构简式)