题目内容
17.在含有Fe3+、Fe2+、Al3+、Cl-的稀溶液中,加入足量的Na2O2固体并微热,充分反应后,再加入过量的稀盐酸,完全反应后,离子数目没有明显变化的是( )| A. | Fe3+ | B. | Fe2+ | C. | Al3+ | D. | Cl- |
分析 溶液中加入过量的Na2O2固体,与水反应生成NaOH和氧气,放出热量,钠离子增大,Fe2+被氧化成Fe3+,Fe2+减少;Fe3+、Al3+、NH4+均与碱反应,铝离子转化为偏铝酸根离子,Fe3+转化为氢氧化铁,NH4+转化为一水合氨和氨气,故NH4+减少;再通入过量的稀盐酸,溶液中氢氧化铁转化为铁离子,铁离子增多,偏铝酸根离子转化为铝离子,铝离子保持不变,以此来解答.
解答 解:溶液中加入过量的Na2O2固体,与水反应生成NaOH和氧气,放出热量,钠离子增大,Fe2+被氧化成Fe3+,Fe2+减少;
Fe3+、Al3+、NH4+均与碱反应,铝离子转化为偏铝酸根离子,Fe3+转化为氢氧化铁,NH4+转化为一水合氨和氨气,故NH4+减少;
再通入过量的稀盐酸,溶液中氢氧化铁转化为铁离子,铁离子增多,偏铝酸根离子转化为铝离子,铝离子保持不变;
A.Fe3+增多,故A不选;
B.Fe2+减少,故B选;
C.Al3+浓度保持不变,故C选;
D.加入过量盐酸,Cl-增大,故D不选;
故选C.
点评 本题考查氧化还原反应,为高频考点,把握过氧化钠的性质、发生的离子反应为解答的关键,侧重分析与应用能力的考查,注意氧化还原反应的应用,题目难度不大.

练习册系列答案
 一本好题口算题卡系列答案
一本好题口算题卡系列答案
相关题目
9.下列过程放出热量的是( )
| A. | 氢气在氯气中燃烧 | B. | 液氨气化 | ||
| C. | 碳酸钙分解 | D. | H-Cl→H+Cl |
6.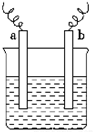 如图中,两电极上发生的电极反应如下:a极:Cu2++2e-═Cu;b极:Fe-2e-═Fe2+,则以下说法中不正确的是( )
如图中,两电极上发生的电极反应如下:a极:Cu2++2e-═Cu;b极:Fe-2e-═Fe2+,则以下说法中不正确的是( )
 如图中,两电极上发生的电极反应如下:a极:Cu2++2e-═Cu;b极:Fe-2e-═Fe2+,则以下说法中不正确的是( )
如图中,两电极上发生的电极反应如下:a极:Cu2++2e-═Cu;b极:Fe-2e-═Fe2+,则以下说法中不正确的是( )| A. | 该装置一定是原电池 | |
| B. | a极上一定发生还原反应 | |
| C. | a、b可以是同种电极材料 | |
| D. | 该过程中能量的转换可以是电能转化为化学能 |
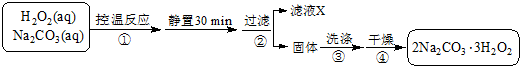
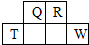 短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T的单质既可与盐酸反应,又可与NaOH溶液反应,请回答下列问题:
短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T的单质既可与盐酸反应,又可与NaOH溶液反应,请回答下列问题: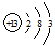 .
.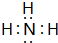
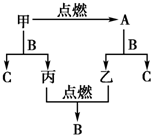 A、B、C是三种常见的化合物,A为淡黄色固体.它们之间的转化关系如图所示.
A、B、C是三种常见的化合物,A为淡黄色固体.它们之间的转化关系如图所示.