题目内容
17.现有①KMnO4 ②H2 ③O2 ④Cl2 ⑤CO ⑥Al 六种物质,从氧化性、还原性的角度分类,若将常用的氧化剂放入甲中,常用的还原剂放入乙中,则:(1)甲中有①③④;乙中有②⑤⑥.(填序号)
(2)用单线桥标出下列化学反应中电子转移的方向和数目.Fe2O3+3CO=2Fe+3CO2
(3)配平下列化学反应方程式:1K2Cr2O7+14HCl=2KCl+2CrCl3+3 Cl2+7H2O,上述反应中,当生成33.6LCl2(标准状况)时,被氧化的HCl的物质的量为3mol,转移电子的数目为3NA个.
分析 (1)氧化剂中元素的化合价为较高价,还原剂中元素的化合价为较低价;
(2)3CO+Fe2O3$\frac{\underline{\;高温\;}}{\;}$3CO2+2Fe,反应中Fe元素的化合价降低,C元素的化合价升高,3molCO参加反应失去6mol电子;
(3)反应中Cr元素化合价变化为:+6→+3;氯化氢中氯元素化合价变化为:-1→0,依据氧化还原反应得失电子守恒、原子个数守恒书写方程式;
依据方程式1K2Cr2O7+14HCl=2KCl+2CrCl3+3 Cl2+7H2O,生成3mol氯气转移6mol电子,被氧化的氯化氢的物质的量为6mol,据此计算当生成33.6LCl2(标准状况)时,被氧化的HCl的物质的量和转移电子数.
解答 解:(1)①KMnO4、③O2、④Cl2 中所含有中心元素化合价处于高价态,反应中易得到电子,表现为氧化物性,常做氧化剂;
②H2、⑤CO、⑥Al 中所含中心元素化合价处于低价态,反应中容易失去电子,表现为还原性,常做还原剂;
故答案为;①③④; ②⑤⑥;
(2)3CO+Fe2O3$\frac{\underline{\;高温\;}}{\;}$3CO2+2Fe,反应中Fe元素的化合价降低,C元素的化合价升高,3molCO参加反应失去6mol电子,用双线桥表示为: ;
;
故答案为: ;
;
(3)反应中Cr元素化合价变化为:+6→+3;氯化氢中氯元素化合价变化为:-1→0,1molK2Cr2O7参加反应得到6mol电子,生成1mol氯气则有6molHCl失去6mol电子,二者最小公倍数为6,依据得失电子守恒,K2Cr2O7系数为1,氯气系数为3,依据原子个数守恒,KCl系数为2,CrCl3系数为2,依据氯原子个数守恒,HCl系数为14,依据氢原子个数守恒则水分子系数为7,方程式:1K2Cr2O7+14HCl=2KCl+2CrCl3+3 Cl2+7H2O,
33.6LCl2(标准状况)物质的量=$\frac{33.6L}{22.4L/mol}$=1.5mol,依据方程式1K2Cr2O7+14HCl=2KCl+2CrCl3+3 Cl2+7H2O,生成3mol氯气转移6mol电子,被氧化的氯化氢的物质的量为6mol,所以生成1.5mol氯气
被氧化的氯化氢的物质的量为3mol,转移电子数为3mol,个数为3NA;
故答案为:1 14 2 2 3 7;3mol; 3NA;
点评 本题考查氧化还原反应,把握反应中元素的化合价变化为解答的关键,注意从物质所含元素化合价高低判断物质的氧化性与还原性的方法,题目难度中等.

 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案| A. | 与电源正极相连的是电解池的阴极 | B. | 与电源负极相连的是电解池的阴极 | ||
| C. | 在电解池的阳极发生的是氧化反应 | D. | 若用铁做阴极,则铁不会被氧化 |
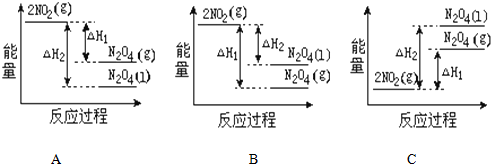
(2)已知:2NO2(g)═N2O4(g)△H1 2NO2(g)═N2O4(l)△H2
下列能量变化示意图中,正确的是(选填字母)A.
(3)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的焓变进行推算.
已知:C(s,石墨)+O2(g)═CO2(g)△H1=-393.5kJ•mol-1
2H2(g)+O2(g)═2H2O(l)△H2=-571.6kJ•mol-1
2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l)△H3=-2 599kJ•mol-1
根据盖斯定律,计算298K时由C(s,石墨)和H2(g)生成1mol C2H2(g)反应的焓变(列出简单的计算式):+226.7kJ•mol-1.
(4)甲醇是一种新型的汽车动力燃料,工业上可通过CO和H2化合来制备甲醇气体(结构简式为CH3OH). 已知某些化学键的键能数据如表:
| 化学键 | C-C | C-H | H-H | C-O | C≡O | H-O |
| 键能/kJ•mol-1 | 348 | 413 | 436 | 358 | 1072 | 463 |
| A. | 能电离出H+的化合物叫做酸 | |
| B. | 实验测得1mol某气体体积为22.4L,测定条件一定是标准状况 | |
| C. | 将饱和氯化铁溶液滴入稀氢氧化钠溶液中加热,可得氢氧化铁胶体 | |
| D. | 碱性氧化物一定是金属氧化物 |
| A. | 为提高高锰酸钾溶液的氧化能力,用盐酸将高锰酸钾溶液进行酸化 | |
| B. | 实验室配制FeCl3溶液时,先将FeCl3溶于浓盐酸再加水稀释 | |
| C. | 从海带灰中提取碘时,为了使I-既能完全转化为I2,又对环境无影响,可选H2O2作氧化剂 | |
| D. | 制备硫酸亚铁铵晶体,在蒸发皿中蒸发浓缩溶液时,不能将溶液全部蒸干 |
| N≡N | O=O | N-N | N-H | O-H | |
| 键能(KJ•mol-1) | 946 | 497 | 154 | 391 | 463 |
Ⅱ.密闭容器中进行反应:3Fe(s)+4H2O(g)?Fe3O4(s)+4H2(g)△H<02反应的化学平衡表达式为K=$\frac{{c}^{4}({H}_{2})}{{c}^{4}({H}_{2}O)}$.
(2)已知:600℃时,上述反应的平衡常数K=16.现有如图1甲(恒温恒压)和如图1乙(恒温恒容)两容器,起始时按下表所示分别加入各物质,体积为2L,在600℃时反应经过一段时间后均达平衡.
| Fe | H2O(g) | Fe3O4 | H2 | |
| 甲/mol | 2.0 | 1.0 | 2.0 | 0.5 |
| 乙/mol | 2.0 | 2.0 | 2.0 | 1.0 |

①关于甲、乙容器,下列说法正确的是AB
A.反应开始时两容器内的逆反应速率:甲<乙
B.若甲容器内气体的密度不再变化,则说明反应已达到平衡状态
C.若乙容器内气体的压强不再变化,则说明反应已达到平衡状态
D.平衡后添加Fe3O4 ,两容器内的平衡均逆向移动
②投料后甲5min达平衡,则此段时间内的平均反应速率v(H2)=0.05mol/(L•min-1)
③平衡后若将乙容器体系温度突然降低100℃,如图2下述图象中能正确反映平衡移动过程中容器内变化情况的是B.
3为恒容绝热容器,进行上述反应,起始与平衡时的各物质的量见下表:
| Fe | H2O(g) | Fe3O4 | H2 | |
| 起始/mol | 3.0 | 3.0 | 0 | 0 |
| 平衡/mol | m | n | p | q |
| Fe | H2O(g) | Fe3O4 | H2 | |
| A/mol | 3.0 | 3.0 | 0 | 0 |
| B/mol | 0 | 0 | 3.0 | 3.0 |
| C/mol | m | n | p | q |
| 主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 二 | ① | ② | ③ | |||||
| 三 | ④ | ⑤ | ⑥ | ⑦ | ||||
| 四 | ⑧ | ⑨ |
(2)元素的最高价氧化物对应的水化物中酸性最强的是HClO4;
(3)最高价氧化物具有两性的是Al2O3;
(4)④、⑤、⑥、⑧的离子半径由大到小为Cl->K+>Na+>Al3+;
(5)写出证明非金属性⑥比⑨强(用置换反应证明)的化学方程式2NaBr+Cl2=2NaCl+Br2;
(6)元素②、⑥与氢元素形成的一种常见化合物含有的化学键类型有离子键、共价键;其电子式为
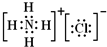 .
.  (1)1.00g CH4完全燃烧生成液态水和CO2,放出55.6kJ热量,写出表示CH4的燃烧热的热化学方程式CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-889.6KJ•mol-1.
(1)1.00g CH4完全燃烧生成液态水和CO2,放出55.6kJ热量,写出表示CH4的燃烧热的热化学方程式CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-889.6KJ•mol-1. X、M、W是原子序数依次增大的前四周期元素,X元素原子核外有三个能
X、M、W是原子序数依次增大的前四周期元素,X元素原子核外有三个能