��Ŀ����
13�����ſ�ѧ�����ķ�չ�ͻ���Ҫ��IJ�����ߣ�CO2�IJ������ü�����Ϊ�о����ص㣮��l��Ŀǰ���ʿռ�վ����CO2��һ����Ҫ�����ǽ�CO2��ԭ�����漰�ķ�Ӧ����ʽΪ��CO2��g��+4H2��g�� $\stackrel{RU}{?}$CH4��g��+2H2O��g��
��֪CO2������������¶ȵ����߶����ӣ�
���¶ȴ�300������400�棬���´ﵽƽ�⣬�ж����и��������ı仯����ѡ���������С�����䡱��
v������v������ƽ�ⳣ��K��С��ת���ʦ���С��
��2����ͬ�¶�ʱ��������Ӧ�ڲ�ͬ��ʼŨ���·ֱ�ﵽƽ�⣬�����ʵ�ƽ��Ũ�������
| [CO2]/mol•L-1 | [H2]/mol•L-1 | [CH4]/mol•L-1 | [H2O]/mol•L-1 | |
| ƽ��� | a | b | c | d |
| ƽ��� | m | n | x | y |
��3������ѪҺ�е�̼���̼�����δ���ƽ�⣺H++HCO3-?H2CO3�������������Ի�������ʽ���ѪҺ��ʱ��ѪҺ��pH�仯������ƽ���ƶ�ԭ�������������������������ʽ���ѪҺ�У�ƽ�������ƶ���ʹH+Ũ�ȱ仯��С��ѪҺ�е�pH�������䣻�������������ʽ���ѪҺ�У�ƽ�������ƶ���ʹH+Ũ�ȱ仯��С��ѪҺ��pH��������
��4��CO2��KO2�����з�Ӧ��4KO2+2CO2��2K2CO3+3O2 4KO2+4CO2+2H2O��4KHCO3+3O2
��9molCO2���ܷ���ں�KO2��Ӧ������9molO2����Ӧǰ�ܷ����H20����Ӧ����3mol��
���� ��1��H2������������¶ȵ����߶����ӣ���˵�������¶�ƽ���淴Ӧ������У�������Ӧ�Ƿ��ȷ�Ӧ�������¶������淴Ӧ���ʾ�����ƽ���淴Ӧ������У�ƽ�ⳣ����С����Ӧ���ת���ʼ�С��
��2����ͬ�¶�ʱƽ�ⳣ�����䣬��K=$\frac{c{d}^{2}}{a{b}^{4}}$=$\frac{x{y}^{2}}{m{n}^{4}}$��
��3������ƽ���֪�������������ʽ���ѪҺ�У�ƽ�������ƶ���ʹH+Ũ�ȱ仯��С��ѪҺ�е�pH�������䣻�������������ʽ���ѪҺ�У�ƽ�������ƶ���ʹH+Ũ�ȱ仯��С��ѪҺ��pH�������䣻
��4��9 mol CO2���ܷ���ں�KO2��Ӧ������9 mol O2����n��CO2����n��O2��=1��1��������������ʽ��ӵõ�8KO2+6CO2+2H2O��2K2CO3+4KHCO3+6O2�����ݷ���ʽ��������ˮ������
��� �⣺��1��H2������������¶ȵ����߶����ӣ���˵�������¶�ƽ���淴Ӧ������У�������Ӧ�Ƿ��ȷ�Ӧ�������¶������淴Ӧ���ʾ�����ƽ���淴Ӧ������У�ƽ�ⳣ����С����Ӧ���ת���ʼ�С��
�ʴ�Ϊ����������С����С��
��2����ͬ�¶�ʱƽ�ⳣ�����䣬��a��b��c��d��m��n��x��y֮��Ĺ�ϵʽΪ��K=$\frac{c{d}^{2}}{a{b}^{4}}$=$\frac{x{y}^{2}}{m{n}^{4}}$��
�ʴ�Ϊ��$\frac{c{d}^{2}}{a{b}^{4}}$=$\frac{x{y}^{2}}{m{n}^{4}}$��
��3������ƽ���֪�������������ʽ���ѪҺ�У�ƽ�������ƶ���ʹH+Ũ�ȱ仯��С��ѪҺ�е�pH�������䣻�������������ʽ���ѪҺ�У�ƽ�������ƶ���ʹH+Ũ�ȱ仯��С��ѪҺ��pH�������䣬
�ʴ�Ϊ���������������ʽ���ѪҺ�У�ƽ�������ƶ���ʹH+Ũ�ȱ仯��С��ѪҺ�е�pH�������䣻�������������ʽ���ѪҺ�У�ƽ�������ƶ���ʹH+Ũ�ȱ仯��С��ѪҺ��pH�������䣻
��4���������ַ������
����һ�������⣬9 mol CO2���ܷ���ں�KO2��Ӧ������9 mol O2����n��CO2����n��O2��=1��1��ͨ���۲������������ʽ��֪��������������ʽ���ʱ���÷�����ĿҪ��8KO2+6CO2+2H2O��2K2CO3+4KHCO3+6O2
������n��H2O��=$\frac{1}{3}$n��CO2��=$\frac{1}{3}$��9mol=3mol������Ӧǰ�ܷ����H2O�����ʵ���Ϊ3mol��
���������跴Ӧǰ�ܷ����H2O�����ʵ���Ϊn
4KO2+4CO2+2H2O��4KHCO3+3O2
2n n 1.5n
4KO2+2CO2��2K2CO3+3O2
9-2n 1.5��9-2n��
����������������9mol��������1.5n+1.5��9-2n��=9mol�����n=3mol������Ӧǰ�ܷ����H2O�����ʵ���Ϊ3mol��
�ʴ�Ϊ��3mol��
���� ���⿼���Ϊ�ۺϣ��漰��ѧƽ�ⳣ��������Ũ�ȴ�С�Ƚ��Լ�������ʵĵ����֪ʶ��Ϊ�߿��������ͺ�Ƶ���㣬������ѧ���ķ��������������Ŀ��飬ע�����ƽ�ⳣ�������壬��Ŀ�Ѷ��еȣ�

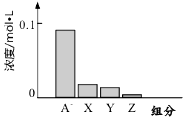 �����£�0.2mol/L��һԪ��HA���Ũ�ȵ�NaOH��Һ�������Ϻ�������Һ�ж�������ּ�Ũ����ͼ��ʾ������˵����ȷ���ǣ�������
�����£�0.2mol/L��һԪ��HA���Ũ�ȵ�NaOH��Һ�������Ϻ�������Һ�ж�������ּ�Ũ����ͼ��ʾ������˵����ȷ���ǣ�������| A�� | HAΪǿ�� | B�� | �û��ҺpH=7 | ||
| C�� | ͼ��X��ʾHA��Y��ʾOH-��Z��ʾH+ | D�� | �û����Һ�У�c��A-��+c��Y��=c��Na+�� |
2NH3��g��+CO2��g���TCO��NH2��2��s��+H2O��g��
��1����һ����պ����ܱ������г���CO2��NH3����������Ӧ�ϳ����أ��㶨�¶��»�������еİ���������ͼ1��ʾ��A�������Ӧ����v����CO2����B����淴Ӧ����v����CO2�������������������=������
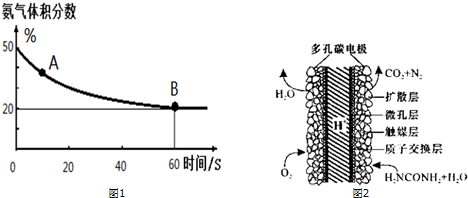
������ƽ��ת����Ϊ75%��
��2������������Ǻϳ����ص�һ���м����������Ϊ2��1��NH3��CO2����������һ���ݻ����������ܱ������У��ں㶨�¶���ʹ�䷢�����з�Ӧ���ﵽƽ�⣺
2NH3��g��+CO2��g���TNH2COONH4��s��
��ʵ���õIJ�ͬ�¶��µ�ƽ�����������±���
| �¶ȣ��棩 | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| ƽ��������Ũ�� ��10-3mol/L�� | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
A����H��0����S��0 B����H��0����S��0
C����H��0����S��0 D����H��0����S��0
�ڹ���������Ӧ��ƽ��״̬����˵����ȷ����C
A������������İ�������泥���Ӧ���ת���ʽ�����
B��ƽ��ʱ������ϵ�¶ȣ�CO2����������½�
C��NH3��ת����ʼ�յ���CO2��ת����
D��������Ч�Ĵ����ܹ���߰�������淋IJ���
�۰�������識���ˮ���̼��泥���������ˮ������ף�����������立�ĩ����1L0.1mol/L��������Һ��ֱ��pH=7�������£�������Һ����仯��������ȥ0.052mol��������泥���ʱ��Һ�м�������̼Ԫ�أ�
��ʱ��Һ��c��NH4+��=0.1mol/L�����������ֵ��
NH4+ˮ��ƽ�ⳣ��ֵΪ4��10-9��
��3����ѧ�������о����ض���ȼ�ϵ�أ���ҺҲ�ܷ��磡�����ֵ��ֱ��ȥ�����з�ˮ�е����أ����ܲ���������ˮ���ܷ��磮����ȼ�ϵ�ؽṹ��ͼ2��ʾ��д���õ�صĸ�����Ӧʽ��CO��NH2��2+H2O-6e-�TN2��+CO2��+6H+��
| A�� | ��ɫ��Ⱦ��ָ����ϩ��������ϩ���������� | |
| B�� | ��֬�����������ʣ���һ����Ȼ�л��߷��ӻ����� | |
| C�� | ��ȡ����������������ֹʹ�������ã�����������к��������������ڶ�Ʒ | |
| D�� | �������벻�㣬������Ѫ�ǣ���������࣬�������������Ӳ�������IJ��ȼ��� |
| A�� | �γɺϽ�����۵�Ҫ��� | B�� | �Ͻ��ǻ���� | ||
| C�� | �Ͻ���й̶����۵� | D�� | ����ǽ����ȣ����Ⱥ����γɺϽ� |

