题目内容
1.煤炭燃烧时产生的大量S02、NO对环境影响极大,需严格控制二者的产生与排放.(1)实验证明生成NO的主要原因为髙温时煤燃烧的中间产物NH3、HCN等会被迅速 氧化为NO.请写出此条件下,HCN被氧化为NO的化学反应方程式4HCN+7O2═4CO2+4NO+2H2O.
(2)研究人员发现,将煤炭在O2/CO2的气氛下燃烧,能够降低燃煤时NO的排放,主要反应为:2NO(g)+2CO(g)═N2(g)+2CO2 (g)△H
已知:①2NO(g)+2C(8)=N2(g)+2CO(g)△H1=akj•mol-1
②CO(g)═C(s)+$\frac{1}{2}$O2 (g)△H2=bkj•mol-1
③2CO(g)+O2 (g)═2CO2 (g)△H=ckj.mol-1 则△H3=ckj•mol-1
△H=(a+2b+c)kj•mol-1
(3)对于2NO(g)+2CO(g)═N2 (g)+2CO2 (g),在一定温度下,于2L的恒容密闭容器中 充人0.1mol NO和0.3molCO,如图1为容器内的压强(P)与起始压强(P0)的比值 (P/P0)随时间的变化曲线.

①该反应的化学平衡常数表达式为K=$\frac{c({N}_{2}){c}^{2}(C{O}_{2})}{{c}^{2}(NO){c}^{2}(CO)}$.
②0-5min内,该反应的平均反应速率(N2)=0.003mol/(L•min);平衡时NO的转化率为80%.
③若13min时,向该容器中再充入0.06molCO,15min时再次达到平衡,此时容器内P/P0的比值应在图中A点的下方(填“上方”或“下方”).
(4)以连二硫酸盐(S2O42-,)为媒介,使用间接电化学法也可处理燃煤烟气中的NO,装置如图2所示.
①阴极区的电极反应式为2SO32-+4H++2e-=S2O42-+2H2O.
②NO吸收转化后的主要产物为NH4+,若通电一段时间后,阴极区n(SO32- )减少了 0.1mol,则此过程中理论上吸收的NO在标准状况下的体积为448mL.
分析 (1)HCN被氧化为NO,还生成二氧化碳和水;
(2)由①2NO(g)+2C(8)=N2(g)+2CO(g)
②CO(g)═C(s)+$\frac{1}{2}$O2 (g)
③2CO(g)+O2 (g)═2CO2 (g)
结合盖斯定律可知,①+②×2+③得到2NO(g)+2CO(g)═N2(g)+2CO2 (g);
(3)①K为生成物浓度幂之积与反应物浓度幂之积的比;
②压强之比等于物质的量的比,结合三段法计算;
③13min时向容器中再充入0.06 mol CO,若平衡不移动,容器内压强(P)与起始压强(P0)的比值$\frac{P}{{P}_{0}}$=$\frac{n}{{n}_{0}}$$\frac{0.4-0.04+0.06}{0.4}$=1.05;
(4)①阴极区失去电子生成S2O42-;
②结合NO~NH4+~5 e-计算.
解答 解:(1)HCN被氧化为NO的化学反应方程式为4HCN+7O2═4CO2+4NO+2H2O,故答案为:4HCN+7O2═4CO2+4NO+2H2O;
(2)由①2NO(g)+2C(8)=N2(g)+2CO(g)
②CO(g)═C(s)+$\frac{1}{2}$O2 (g)
③2CO(g)+O2 (g)═2CO2 (g)
结合盖斯定律可知,①+②×2+③得到2NO(g)+2CO(g)═N2(g)+2CO2 (g);
所以△H=(a+2b+c)kJ/mol,
故答案为:(a+2b+c);
(3)①由反应可知,化学平衡表达式K=$\frac{c({N}_{2}){c}^{2}(C{O}_{2})}{{c}^{2}(NO){c}^{2}(CO)}$,故答案为:K=$\frac{c({N}_{2}){c}^{2}(C{O}_{2})}{{c}^{2}(NO){c}^{2}(CO)}$;
②由图,5min时,$\frac{P}{{P}_{0}}$=0.925,根据阿伏伽德罗定律推论,同温和同体积时$\frac{P}{{P}_{0}}$=$\frac{n}{{n}_{0}}$=0.925,
2NO (g)+2CO (g)?N2(g)+2CO2(g)
初始 0.1mol 0.3mol 0 0
变化 2x mol 2x mol x mol 2x mol
5min (0.1-2x) mol (0.3-2x) mol x mol 2x mol
$\frac{0.4}{0.4-x}$=0.925,x=0.03 mol
v(N2)=$\frac{0.03mol}{2L×5min}$=0.003 mol/(L•min),
同理,2NO (g)+2CO (g)?N2(g)+2CO2(g)
初始 0.1mol 0.3mol 0 0
变化 2x′mol 2x′mol x′mol 2x′mol
平衡 (0.1-2x′) mol (0.3-2x′) mol x′mol 2x′mol
$\frac{0.4}{0.4-x}$=0.9,x′=0.04 mol,α(NO)=$\frac{0.08}{0.10}$×100%=80%,
故答案为:0.003mol/(L•min);80%;
③13min时向容器中再充入0.06 mol CO,若平衡不移动,容器内压强(P)与起始压强(P0)的比值$\frac{P}{{P}_{0}}$=$\frac{n}{{n}_{0}}$$\frac{0.4-0.04+0.06}{0.4}$=1.05,由于充入CO后增大了反应物的浓度,所以平衡向气体物质的量减少的方向移动,再次平衡后容器内气体物质的量必然少于0.42,所以此时$\frac{P}{{P}_{0}}$<1.05即在A点的下方,
故答案为:下方;
(4)①由图可知,阴极区通入液体主要含SO32-,流出主要含S2O42-,所以阴极区电极反应式为2SO32-+4H++2e-=S2O42-+2H2O,
故答案为:2SO32-+4H++2e-=S2O42-+2H2O;
②若通电一段时间后阴极区n(SO32-)减少了0.1 mol,此过程转移0.1mol e-;由于NO吸收转化后的主要产物为NH4+,NO~NH4+~5e-,若电路中转移转移0.1mol e-,消耗NO 0.02mol,标准状况下体积为448mL,
故答案为:448.
点评 本题考查化学平衡的计算,为高频考点,把握平衡三段法、转化率的计算及平衡移动的影响为解答的关键,侧重分析与计算能力的考查,注意(4)中为解答的难点,题目难度不大.

 名校通行证有效作业系列答案
名校通行证有效作业系列答案| A. | 体积相同 | B. | 碳原子数相同 | C. | 分子数相同 | D. | 质量不相同 |
| A. |  | B. |  | ||
| C. |  | D. |  |
(l)目前国际空间站处理CO2的一个重要方法是将CO2还原,所涉及的反应方程式为:CO2(g)+4H2(g) $\stackrel{RU}{?}$CH4(g)+2H2O(g)
已知CO2的体积分数随温度的升高而增加.
若温度从300℃升至400℃,重新达到平衡,判断下列各物理量的变化.(选填“增大”、“减小”或“不变”)
v正增大,v逆增大,平衡常数K减小,转化率α减小.
(2)相同温度时,上述反应在不同起始浓度下分别达到平衡,各物质的平衡浓度如表:
| [CO2]/mol•L-1 | [H2]/mol•L-1 | [CH4]/mol•L-1 | [H2O]/mol•L-1 | |
| 平衡Ⅰ | a | b | c | d |
| 平衡Ⅱ | m | n | x | y |
(3)人体血液中的碳酸和碳酸氢盐存在平衡:H++HCO3-?H2CO3,当有少量酸性或碱性物质进入血液中时,血液的pH变化不大,用平衡移动原理解释上述现象.当少量酸性物质进入血液中,平衡向右移动,使H+浓度变化较小,血液中的pH基本不变;当少量碱性物质进入血液中,平衡向左移动,使H+浓度变化较小,血液的pH基本不变
(4)CO2和KO2有下列反应:4KO2+2CO2→2K2CO3+3O2 4KO2+4CO2+2H2O→4KHCO3+3O2
若9molCO2在密封舱内和KO2反应后生成9molO2,则反应前密封舱内H20的量应该是3mol.
 中国是中草药的发源地,目前中国大约有12000种药用植物,从某中草药提取的有机物结构如图所示,该有机物的下列说法中不正确的是( )
中国是中草药的发源地,目前中国大约有12000种药用植物,从某中草药提取的有机物结构如图所示,该有机物的下列说法中不正确的是( )| A. | 分子式为C14H18O6 | |
| B. | 环上氢原子的一氯取代物5种 | |
| C. | 1mol该有机物与足量的金属钠反应产生4mol H2 | |
| D. | 分子间能发生酯化反应 |
 的名称是2,5,5-三甲基-3-乙基-庚烷
的名称是2,5,5-三甲基-3-乙基-庚烷 .
. .
. D.
D. 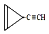 ,其中A、B是链状分子(不考虑这些结构能否稳定存在),请写出所有碳原子均共线的一种链状分子的结构简式:CH≡C-C≡C-CH3.
,其中A、B是链状分子(不考虑这些结构能否稳定存在),请写出所有碳原子均共线的一种链状分子的结构简式:CH≡C-C≡C-CH3. 分子中最多有23个原子共面.
分子中最多有23个原子共面.