题目内容
3.形成合金的叙述错误的是( )| A. | 形成合金后,其熔点要提高 | B. | 合金是混合物 | ||
| C. | 合金具有固定的熔点 | D. | 铁与非金属氯,氧等很难形成合金 |
分析 A.合金的熔点比各成分熔点低;
B.合金是指在一种金属中加热熔合其它金属或非金属而形成的具有金属特性的物质;
C.合金为混合物,无固定沸点;
D.氯气氧气的沸点低于铁的熔点.
解答 解:A.形成合金后,其熔点一般会降低,故A错误;
B.合金是指在一种金属中加热熔合其它金属或非金属而形成的具有金属特性的物质,属于混合物,故B正确;
C.合金属于混合物,无固定熔沸点,故C错误;
D.氯气氧气的沸点低于铁的熔点,无法形成合金,故D正确;
故选AC.
点评 本题考查合金,题目难度不大,注意把握相关基础知识的积累,注意合金的熔点比其成分金属都低,而不是在二者之间.

练习册系列答案
 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案
相关题目
13.随着科学技术的发展和环保要求的不断提高,CO2的捕集利用技术成为研究的重点.
(l)目前国际空间站处理CO2的一个重要方法是将CO2还原,所涉及的反应方程式为:CO2(g)+4H2(g) $\stackrel{RU}{?}$CH4(g)+2H2O(g)
已知CO2的体积分数随温度的升高而增加.
若温度从300℃升至400℃,重新达到平衡,判断下列各物理量的变化.(选填“增大”、“减小”或“不变”)
v正增大,v逆增大,平衡常数K减小,转化率α减小.
(2)相同温度时,上述反应在不同起始浓度下分别达到平衡,各物质的平衡浓度如表:
a、b、c、d与m、n、x、y之间的关系式为$\frac{c{d}^{2}}{a{b}^{4}}$=$\frac{x{y}^{2}}{m{n}^{4}}$.
(3)人体血液中的碳酸和碳酸氢盐存在平衡:H++HCO3-?H2CO3,当有少量酸性或碱性物质进入血液中时,血液的pH变化不大,用平衡移动原理解释上述现象.当少量酸性物质进入血液中,平衡向右移动,使H+浓度变化较小,血液中的pH基本不变;当少量碱性物质进入血液中,平衡向左移动,使H+浓度变化较小,血液的pH基本不变
(4)CO2和KO2有下列反应:4KO2+2CO2→2K2CO3+3O2 4KO2+4CO2+2H2O→4KHCO3+3O2
若9molCO2在密封舱内和KO2反应后生成9molO2,则反应前密封舱内H20的量应该是3mol.
(l)目前国际空间站处理CO2的一个重要方法是将CO2还原,所涉及的反应方程式为:CO2(g)+4H2(g) $\stackrel{RU}{?}$CH4(g)+2H2O(g)
已知CO2的体积分数随温度的升高而增加.
若温度从300℃升至400℃,重新达到平衡,判断下列各物理量的变化.(选填“增大”、“减小”或“不变”)
v正增大,v逆增大,平衡常数K减小,转化率α减小.
(2)相同温度时,上述反应在不同起始浓度下分别达到平衡,各物质的平衡浓度如表:
| [CO2]/mol•L-1 | [H2]/mol•L-1 | [CH4]/mol•L-1 | [H2O]/mol•L-1 | |
| 平衡Ⅰ | a | b | c | d |
| 平衡Ⅱ | m | n | x | y |
(3)人体血液中的碳酸和碳酸氢盐存在平衡:H++HCO3-?H2CO3,当有少量酸性或碱性物质进入血液中时,血液的pH变化不大,用平衡移动原理解释上述现象.当少量酸性物质进入血液中,平衡向右移动,使H+浓度变化较小,血液中的pH基本不变;当少量碱性物质进入血液中,平衡向左移动,使H+浓度变化较小,血液的pH基本不变
(4)CO2和KO2有下列反应:4KO2+2CO2→2K2CO3+3O2 4KO2+4CO2+2H2O→4KHCO3+3O2
若9molCO2在密封舱内和KO2反应后生成9molO2,则反应前密封舱内H20的量应该是3mol.
14.某密闭容器中充入等物质的量的A和B,一定温度下发生反应A(g)+xB(g)?2C(g),达到平衡后,在不同的时间段,分别改变反应的一个条件,测得容器中物质的物质的量浓度、反应速率分别随时间的变化如图所示:下列说法中正确的是( )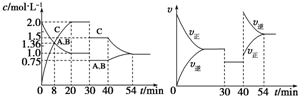

| A. | 30~40 min 间该反应使用了催化剂 | |
| B. | 反应方程式中的x=1,正反应为吸热反应 | |
| C. | 30 min 时降低温度,40 min 时升高温度 | |
| D. | 30 min时减小压强,40 min时升高温度 |
12.己知反应2FeCl3+Cu=CuCl2+2FeCl2,则下列判断正确的是( )
| A. | 该反应是置换反应 | B. | 该反应中FeCl3作还原剂 | ||
| C. | 还原性:Cu>Fe2+ | D. | 氧化性:CuCl2>FeCl3 |