题目内容
在给定的四种溶液中,含有以下各种微粒,一定能大量共存的是( )
| A、饱和Na2CO3溶液中:NH4+、C6H5OH、NO3-、NH3?H2O |
| B、常温下葡萄糖溶液中:SCN-、Cl-、K+、NH4+ |
| C、溴水中:Na+、CO32-、NH4+、SO42- |
| D、pH大于7的溶液:Na+、Ba2+、SO32-、ClO- |
考点:离子共存问题
专题:
分析:A.C6H5OH具有酸性,与碱或碱性溶液反应;
B.葡萄糖溶液为中性;
C.溴水中含氢离子;
D.离子之间结合生成沉淀.
B.葡萄糖溶液为中性;
C.溴水中含氢离子;
D.离子之间结合生成沉淀.
解答:
解:A.C6H5OH具有酸性,与NH3?H2O或Na2CO3溶液反应,不能大量共存,故A错误;
B.葡萄糖溶液为中性,该组离子之间不反应,可大量共存,故B正确;
C.溴水中含氢离子,不能大量存在CO32-,故C错误;
D.pH大于7的溶液,显碱性,Ba2+、SO32-结合生成沉淀,不能大量共存,故D错误;
故选B.
B.葡萄糖溶液为中性,该组离子之间不反应,可大量共存,故B正确;
C.溴水中含氢离子,不能大量存在CO32-,故C错误;
D.pH大于7的溶液,显碱性,Ba2+、SO32-结合生成沉淀,不能大量共存,故D错误;
故选B.
点评:本题考查离子的共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重复分解反应的离子共存考查,题目难度不大.

练习册系列答案
 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案
相关题目
同温同压下,等质量的O2 和O3 相比较,下列结论正确的是( )
| A、它们的密度之比为 1:1 |
| B、它们的分子数目之比是 1:1 |
| C、它们的体积之比是 1:1 |
| D、它们的氧原子数目之比为 1:1 |
下列关于Cl2和SO2性质的叙述正确的是( )
| A、Cl2可溶于水,新制氯水显浅黄绿色 |
| B、SO2能使品红溶液褪色说明SO2具有氧化性 |
| C、常温下,等体积的Cl2和SO2混合气体通入BaCl2溶液时,无明显现象 |
| D、等体积的Cl2和SO2分别通入含石蕊的水中,溶液的紫色立即褪去 |
用CuFeS2冶炼钢的反应为8CuFeS2+21O2
8Cu+4FeO+2Fe2O3+16SO2.若CuFeS2中Fe的化合价为+2价,下列关于该反应的说法正确的是( )
| ||
| A、CuFeS2只作还原剂 |
| B、Fe元素全部被氧化 |
| C、还原产物是Cu、FeO、Fe2O3和SO2 |
| D、若生成1molCu,则反应中转移2mol电子 |
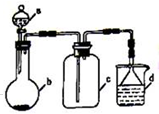 实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置).仅用此装置和表中提供的物质完成相关实验,最合理的选项是( )
实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置).仅用此装置和表中提供的物质完成相关实验,最合理的选项是( )
 ④
④ ⑤
⑤ ⑥
⑥