题目内容
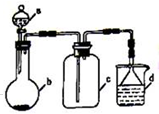 实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置).仅用此装置和表中提供的物质完成相关实验,最合理的选项是( )
实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置).仅用此装置和表中提供的物质完成相关实验,最合理的选项是( )| 选项 | a中的物质 | b中的物质 | C中收集的气体 | d中的物质 |
| A | 浓氨水 | CaO | NH3 | H2O |
| B | 稀硝酸 | Cu | NO2 | H2O |
| C | 稀硝酸 | FeS | H2S | NaOH溶液 |
| D | 浓盐酸 | KMnO4 | Cl2 | NaOH溶液 |
| A、A | B、B | C、C | D、D |
考点:常温反应气体性质实验装置,气体的收集,尾气处理装置
专题:
分析:A、氨气密度小于空气的密度,收集方法应该为向下排空气法;
B、稀硝酸与铜反应生成的是一氧化氮气体,d中用水无法吸收含一氧化氮或二氧化氮的尾气;
C、稀硝酸具有强氧化性,能把硫离子氧化生成硫单质,不能利用稀硝酸与硫化亚铁制取硫化氢;
D、用KMnO4和浓盐酸可在常温下制取氯气.
B、稀硝酸与铜反应生成的是一氧化氮气体,d中用水无法吸收含一氧化氮或二氧化氮的尾气;
C、稀硝酸具有强氧化性,能把硫离子氧化生成硫单质,不能利用稀硝酸与硫化亚铁制取硫化氢;
D、用KMnO4和浓盐酸可在常温下制取氯气.
解答:
解:A、氨气的密度比空气密度小,应该采用向下排空气法收集,装置c中的导管应改为短进长出,故A错误;
B、铜与稀硝酸反应生成产物为一氧化氮,无法达到二氧化氮,一氧化氮、二氧化氮的尾气吸收不能使用水,故B错误;
C、稀硝酸具有强氧化性,能把硫离子氧化生成硫单质,不能利用稀硝酸与硫化亚铁制取硫化氢,故C错误;
D、用KMnO4和浓盐酸可在常温下制取氯气,氯气的密度比空气大,能使用向上排空气法,氯气用氢氧化钠溶液吸收,故D正确;
故选D.
B、铜与稀硝酸反应生成产物为一氧化氮,无法达到二氧化氮,一氧化氮、二氧化氮的尾气吸收不能使用水,故B错误;
C、稀硝酸具有强氧化性,能把硫离子氧化生成硫单质,不能利用稀硝酸与硫化亚铁制取硫化氢,故C错误;
D、用KMnO4和浓盐酸可在常温下制取氯气,氯气的密度比空气大,能使用向上排空气法,氯气用氢氧化钠溶液吸收,故D正确;
故选D.
点评:本题考查化学实验基本原理(气体的制备)、实验装置、仪器的使用,题目难度中等,注意掌握常见气体的制取原理、收集方法及尾气吸收方法,该考点是高考的热点,本题对相关的知识考查的要求较高,本题有利于培养学生对实验的分析能力.

练习册系列答案
相关题目
下列离子方程式书写正确的是( )
| A、Na2CO3溶液中滴加醋酸:CO32-+2H+=H2O+CO2↑ |
| B、Fe和FeCl3溶液:Fe+Fe3+=2 Fe2+ |
| C、AlCl3溶液中加入氨水:Al3++3NH3?H2O=Al(OH)3↓+3NH4+ |
| D、H2SO4溶液和Ba(OH)2溶液:SO42-+Ba2+=BaSO4↓ |
在给定的四种溶液中,含有以下各种微粒,一定能大量共存的是( )
| A、饱和Na2CO3溶液中:NH4+、C6H5OH、NO3-、NH3?H2O |
| B、常温下葡萄糖溶液中:SCN-、Cl-、K+、NH4+ |
| C、溴水中:Na+、CO32-、NH4+、SO42- |
| D、pH大于7的溶液:Na+、Ba2+、SO32-、ClO- |
下表是元素周期表一部分.X、Y、Z均为短周期元素,X、Z的质子数之和为23,下列说法正确的是( )
| X | |||
| Y | Z | ||
| W |
| A、W的原子序数比Z的大9 |
| B、Y的最高价氧化物溶于水,与水反应得到酸 |
| C、W的单质能与Z的一种氧化物的水溶液反应生成两种强酸 |
| D、Z的单质在一定条件下可与铁粉反应,将铁粉氧化为+3价 |
(NH4)2SO4在一定条件下发生如下反应:4(NH4)2SO4→N2↑+6NH3↑+3SO2↑+SO3↑+7H2O将反应后的气体通入一定量的BaCl2溶液中,发现溶液有白色沉淀生成,还有部分气体从溶液中逸出,检验发现从溶液中逸出的气体无色、无味,溶液中氯化钡恰好完全反应.下列说法正确的是( )
| A、生成沉淀中既有BaSO4、又有BaSO3,且n(BaSO4):n(BaSO3)约为1:1 |
| B、生成沉淀中既有BaSO4、又有BaSO3,且n(BaSO4):n(BaSO3)约为1:2 |
| C、生成沉淀中既有BaSO4、又有BaSO3,且n(BaSO4):n(BaSO3)约为1:3 |
| D、从溶液中逸出的气体只有N2,最后留下溶液中溶质只有较多的NH4Cl |
根据原子结构及元素周期律的知识,下列推断正确的是( )
| A、同主族元素含氧酸的酸性随核电荷数的增加而减弱 |
| B、核外电子排布相同的微粒化学性质相同 |
| C、Cl-、S2-、Ca2+、K+半径逐渐减小 |
| D、还原性强弱:F-<Cl-<I- |
设NA表示阿伏加德罗常数的值,下列叙述中正确的是( )
| A、1mol过氧化钠固体与足量的水反应,转移的电子数目为2NA |
| B、Fe在1molCl2中充分燃烧,转移的电子数目为3NA |
| C、将含有0.1molFeCl3的FeCl3饱和溶液,滴入沸水中加热形成Fe(OH)3胶体,所含的胶体粒子数目少于0.1NA |
| D、足量的MnO2粉末与含有4molHCl的浓盐酸充分反应,转移的电子数目为2NA |
a、b、c三种短周期金属元素,原子序数依次增大,单质的物质的量分别为n(a)、n(b)、n(c),它们与足量盐酸反应产生的氢气体积(标准状况下)为V(H2)a、V(H2)b、V(H2)c.当n(a)=n(b)=n(c),则2V(H2)a=V(H2)b+V(H2)c,下列说法中正确的是( )
| A、a、b、c可能是同周期元素 |
| B、a可能是镁元素 |
| C、b、c两者的最高价氧化物对应的水化物能反应 |
| D、工业上冶炼b、c通常是用电解法制得 |