题目内容
4.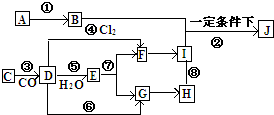 A→J有如图所示的转化关系(反应条件、部分反应物和产物已忽略):其中A、D为银白色金属单质;B为淡黄色粉末,C为红棕色粉末,E为黑色晶体;H久置于空气中,由白色固体变为灰绿色,最终变成红褐色Ⅰ;B和I在一定条件下反应生成J,J的化学式为Na2FeO4,它能够杀菌消毒,是一种优良的净水剂.
A→J有如图所示的转化关系(反应条件、部分反应物和产物已忽略):其中A、D为银白色金属单质;B为淡黄色粉末,C为红棕色粉末,E为黑色晶体;H久置于空气中,由白色固体变为灰绿色,最终变成红褐色Ⅰ;B和I在一定条件下反应生成J,J的化学式为Na2FeO4,它能够杀菌消毒,是一种优良的净水剂.(1)物质C俗称铁红物质B的一种用途供氧剂
(2)写出下列反应的化学反应方程式:
⑤3Fe+4H2O$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2
⑧Fe(OH)2+O2+2H2O═4 Fe(OH)3
(3)写出反应的离子方程式:⑦Fe3O4+8H+=Fe2++2Fe3++4H2O
(4)在①-⑧的所有反应中,属于非氧化还原反应的有(填序号)⑦
(5)根据Na2FeO4元素的价态及反应前后的产物推测Na2FeO4杀菌消毒做净水剂的原因Na2FeO4中铁元素为+6价,具有强氧化性,可以杀菌、消毒; Na2FeO4中+6价铁元素得电子后生成了Fe3+,Fe3+水解生成氢氧化铁胶体,氢氧化铁胶体可以吸附水中的悬浮杂质而净水.
分析 H久置于空气中,由白色固体变为灰绿色,最终变成红褐色Ⅰ,则H为Fe(OH)2,I为Fe(OH)3,C为红棕色粉末,则C为Fe2O3,D为Fe,F为FeCl3,E为黑色晶体,则E为Fe3O4,反应⑦为Fe3O4与盐酸反应,则G为FeCl2,银白色金属单质A转化得到B为淡黄色粉末,则A为Na,B为Na2O2,据此解答.
解答 解:H久置于空气中,由白色固体变为灰绿色,最终变成红褐色Ⅰ,则H为Fe(OH)2,I为Fe(OH)3,C为红棕色粉末,则C为Fe2O3,D为Fe,F为FeCl3,E为黑色晶体,则E为Fe3O4,反应⑦为Fe3O4与盐酸反应,则G为FeCl2,银白色金属单质A转化得到B为淡黄色粉末,则A为Na,B为Na2O2.
(1)物质C为Fe2O3,俗称铁红,物质B为Na2O2,可以用作供氧剂等,
故答案为:铁红;供氧剂;
(2)反应⑤的化学反应方程式:3Fe+4H2O$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2,
反应⑧的化学反应方程式:4Fe(OH)2+O2+2H2O═4 Fe(OH)3,
故答案为:3Fe+4H2O$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2;4Fe(OH)2+O2+2H2O═4 Fe(OH)3;
(3)反应⑦的离子方程式:Fe3O4+8H+=Fe2++2Fe3++4H2O,
故答案为:Fe3O4+8H+=Fe2++2Fe3++4H2O;
(4)在①-⑧的所有反应中,反应⑦为Fe3O4与盐酸反应,属于非氧化还原反应,其它均为氧化还原反应,
故答案为:⑦;
(5)Na2FeO4中铁元素为+6价,具有强氧化性,可以杀菌、消毒; Na2FeO4中+6价铁元素得电子后生成了Fe3+,Fe3+水解生成氢氧化铁胶体,氢氧化铁胶体可以吸附水中的悬浮杂质而净水,
故答案为:Na2FeO4中铁元素为+6价,具有强氧化性,可以杀菌、消毒; Na2FeO4中+6价铁元素得电子后生成了Fe3+,Fe3+水解生成氢氧化铁胶体,氢氧化铁胶体可以吸附水中的悬浮杂质而净水.
点评 本题考查无机物推断,主要涉及Fe元素单质化合物性质,物质的颜色是推断突破口,熟练掌握元素化合物性质,难度中等.

 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案| 被提纯的物质[括号内物质是杂质] | 除杂试剂 | 反应的离子方程式 | |
| 1 | NaHCO3溶液( Na2CO3) | ||
| 2 | NaCl溶液 (MgCl2) | ||
| 3 | KNO3溶液(KCl) | ||
| 4 | Cu(Mg) |
 和
和 的是( )
的是( )| A. | Na | B. | HNO3 | C. | NaOH | D. | HCl |
| A. | 标准状况下,22.4LSO3含有的分子数NA | |
| B. | 常温常压下,4.4gCO2的物质的量一定为0.1mol | |
| C. | 标准状况下,氧原子总数为0.2NA的SO2和O2的混合气体,其体积为2.24L | |
| D. | 7.8gNa2S和7.8gNa2O2中含有的阴离子数目均为0.1NA |
| A. | 可以用碱石灰来干燥SO2气体 | |
| B. | 通入BaCl2溶液中,能生成白色沉淀 | |
| C. | 因为SO2有漂白性,所以它能使品红溶液、溴水褪色 | |
| D. | 将SO2气体通入装有品红溶液的试管里,红色逐渐褪去,给试管加热恢复红色 |
 NH4+(2)
NH4+(2)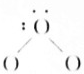 H2O(3)
H2O(3)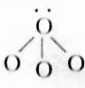 NH3
NH3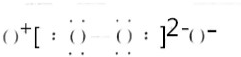 Na2O2(5)
Na2O2(5)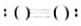 N2
N2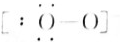 OH-(7)
OH-(7)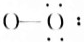 HF.
HF.