题目内容
16.实验室可用高锰酸钾和浓盐酸快速制取少量氯气,反应的化学方程式为:2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O.取一定量的浓盐酸与高锰酸钾发生反应,产生的氯气在标准状况下的体积为11.2L,计算.(1)参加反应的高锰酸钾的质量:
(2)反应中被氧化的HCl的物质的量;
(3)反应过程中转移的电子数.
分析 (1)根据化学方程式结合氯气的质量进行计算;
(2)被氧化的盐酸中的氯离子全部转化为氯气,据反应方程式计算;
(3)2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O中,5mol的氯气生成转移10mol的电子.
解答 解:(1)制取标准状况下的氯气11.2L,其物质的量的为$\frac{11.2L}{22.4L/mol}$=0.5mol,
由2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O可知,需要高锰酸钾物质的量是0.2mol,质量为0.2mol×158g/mol=31.6g,
答:理论上需要高锰酸钾的质量是31.6g;
(2)根据反应知道,被氧化的HCl的物质的量是参加反应的盐酸的物质的量的$\frac{5}{8}$,得到0.5mol氯气,消耗盐酸是1.6mol,被氧化的盐酸是1.6mol×$\frac{5}{8}$
=1mol,答:被氧化的HCl的物质的量是1mol;
(3)2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O中,5mol的氯气生成转移10mol的电子,而生成氯气为0.5mol,所以转移电子数为NA,答:反应过程中转移的电子数为NA.
点评 本题考查氧化还原反应的计算,为高频考点,把握发生的反应中物质的量的关系为解答的关键,侧重分析与计算能力的考查,题目难度不大.

练习册系列答案
相关题目
7.化学是以一门实验为基础的自然科学,许多实验有丰富的颜色变化,有关实验的颜色变化有错误的是( )
| A. | 钠在氧气中燃烧,产物为淡黄色 | |
| B. | 无水硫酸铜放入医用酒精中变蓝 | |
| C. | 向Fe(NO3)2溶液中滴加稀硫酸,溶液不变色 | |
| D. | 向FeSO4溶液中滴加NaOH溶液,生成沉淀的颜色由白色迅速变为灰绿色,最后变为红褐色 |
11.四份相同质量的铝与足量下列物质发生反应,能放出氢气且消耗溶质物质的量最少的是( )
| A. | 稀硫酸 | B. | 稀硝酸 | C. | 盐酸 | D. | 氢氧化钠溶液 |
1.除去CO2中的H2S气体,不能选用的试剂为( )
| A. | KMnO4 | B. | CuSO4 | C. | NaOH | D. | 双氧水 |
8.铬及其化合物在工业上有许多用途,但化工废料铬渣对人体健康有很大危害,以制革工也产生的含铬污泥为原料,回收污泥中三价铬的工艺流程图如图所示(硫酸浸取液中金属离子主要是Cr3+,其次是Fe3+、Fe2+、Al3+、Ca2+、Mg2+)
:
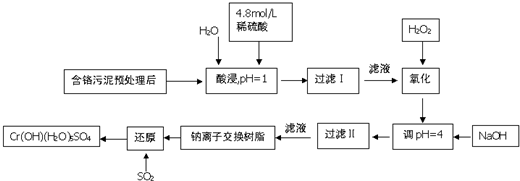
常温下部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
回答下列问题:
(1)能提高浸取时三价铬的浸取率的措施有ABC(填字母)
A.将含铬污泥粉碎并适当延长浸取时间
B.升高温度并不断搅拌
C.多次浸取,合并浸取液
D.缩短浸取时间
(2)氧化过程中加入H2O2,除了把Cr3+氧化为Cr2O72-外,另一个作用时2Fe2++H2O2+2H+=2Fe3++2H2O(用离子方程式表示).
(3)过滤Ⅱ产生的沉淀是Fe(OH)3(填化学式).
(4)钠离子交换树脂的原理为:Mn++nNaR═MRn+nNa+,被交换的杂质离子是Al3+、Ca2+、Mg2+(填离子符号).
(5)每生成1molCr(OH)(H2O)5SO4,消耗SO2物的质量为1.5mol.
(6)工业上可用电解法处理含Cr2O72-的酸性废水,具体方法是将含Cr2O72-的酸性废水放入电解槽内,加入适量的NaCl,以铁和石墨为电极进行电解.经过一段时间后,生成Cr(OH)3和Fe(OH)3沉淀除去.
①铁电极与直流电源正极(填“正极”或“负极”)相连,加入适量NaCl的目的是增大溶液导电能力;
②若电解后的溶液中c(Fe3+)为2.0×10-13mol•L-1,则溶液中c(Cr3+)为3.0×10-6mol/L(已知Ksp[Fe(OH)3]=4.0×10-38,Ksp=[Cr(OH)3]=6.0×10-31)
:

常温下部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 阳离子 | Fe3+ | Fe2+ | Mg2+ | Al3+ | Cr3+ |
| 开始沉淀时的pH | 2.7 | 7.0 | - | - | - |
| 沉淀完全是的pH | 3.7 | 9.0 | 11.1 | 8 | 9(>9溶解) |
(1)能提高浸取时三价铬的浸取率的措施有ABC(填字母)
A.将含铬污泥粉碎并适当延长浸取时间
B.升高温度并不断搅拌
C.多次浸取,合并浸取液
D.缩短浸取时间
(2)氧化过程中加入H2O2,除了把Cr3+氧化为Cr2O72-外,另一个作用时2Fe2++H2O2+2H+=2Fe3++2H2O(用离子方程式表示).
(3)过滤Ⅱ产生的沉淀是Fe(OH)3(填化学式).
(4)钠离子交换树脂的原理为:Mn++nNaR═MRn+nNa+,被交换的杂质离子是Al3+、Ca2+、Mg2+(填离子符号).
(5)每生成1molCr(OH)(H2O)5SO4,消耗SO2物的质量为1.5mol.
(6)工业上可用电解法处理含Cr2O72-的酸性废水,具体方法是将含Cr2O72-的酸性废水放入电解槽内,加入适量的NaCl,以铁和石墨为电极进行电解.经过一段时间后,生成Cr(OH)3和Fe(OH)3沉淀除去.
①铁电极与直流电源正极(填“正极”或“负极”)相连,加入适量NaCl的目的是增大溶液导电能力;
②若电解后的溶液中c(Fe3+)为2.0×10-13mol•L-1,则溶液中c(Cr3+)为3.0×10-6mol/L(已知Ksp[Fe(OH)3]=4.0×10-38,Ksp=[Cr(OH)3]=6.0×10-31)
7.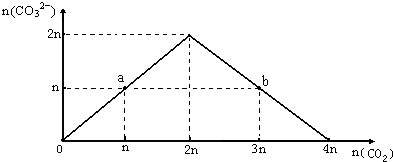 向NaOH溶液中缓慢通入CO2气体,溶液中CO32-的物质的量与通入CO2物质的量的关系图如下.下列关于图中a、b两点溶液的说法错误的是( )
向NaOH溶液中缓慢通入CO2气体,溶液中CO32-的物质的量与通入CO2物质的量的关系图如下.下列关于图中a、b两点溶液的说法错误的是( )
 向NaOH溶液中缓慢通入CO2气体,溶液中CO32-的物质的量与通入CO2物质的量的关系图如下.下列关于图中a、b两点溶液的说法错误的是( )
向NaOH溶液中缓慢通入CO2气体,溶液中CO32-的物质的量与通入CO2物质的量的关系图如下.下列关于图中a、b两点溶液的说法错误的是( )| A. | a、b溶液与同浓度盐酸完全反应时,消耗盐酸的体积相同 | |
| B. | a溶液中水的电离程度与b溶液中水的电离程度相同 | |
| C. | a、b两溶液都满足:c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-) | |
| D. | 将a、b两点混合后溶液满足:c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3) |
 A→J有如图所示的转化关系(反应条件、部分反应物和产物已忽略):其中A、D为银白色金属单质;B为淡黄色粉末,C为红棕色粉末,E为黑色晶体;H久置于空气中,由白色固体变为灰绿色,最终变成红褐色Ⅰ;B和I在一定条件下反应生成J,J的化学式为Na2FeO4,它能够杀菌消毒,是一种优良的净水剂.
A→J有如图所示的转化关系(反应条件、部分反应物和产物已忽略):其中A、D为银白色金属单质;B为淡黄色粉末,C为红棕色粉末,E为黑色晶体;H久置于空气中,由白色固体变为灰绿色,最终变成红褐色Ⅰ;B和I在一定条件下反应生成J,J的化学式为Na2FeO4,它能够杀菌消毒,是一种优良的净水剂.