题目内容
15.一定温度下,反应C(s)+H2O(g)?CO(g)+H2(g)在密闭容器中进行,一段时间后达到平衡,下列措施不能使平衡发生移动的是( )①增加C的物质的量 ②保持容器容积不变,充入N2使体系压强增大 ③将容器的容积缩小一半 ④保持压强不变,充入N2使容器容积变大.
| A. | ①② | B. | ②③ | C. | ①④ | D. | ③④ |
分析 对应反应C(s)+H2O(g)?CO(g)+H2(g),有气体参加和生成,则温度、压强都能对化学反应速率产生影响,以此解答该题.
解答 解:①因浓度越大,化学反应速率越快,但是固体量的增减不影响反应速率,所以增加C(s)的量,反应速率不变,平衡不移动,故①选;
②保持体积不变,充入氮气,氮气不参与反应,反应体系中的各物质的浓度不变,则反应速率不变,平衡不移动,故②选;
③将容器的体积缩小一半,增大压强,平衡逆向移动,故③不选;
④保持压强不变,充入氮气,使容器的体积变大,相当减小压强,平衡正向移动,故④不选.
故选A.
点评 本题考查影响化学反应速率的因素,为高频考点,注意该反应中有气体参加和生成时解答本题的关键,并学会利用压强及思维转化的方法来分析解答.

练习册系列答案
相关题目
7.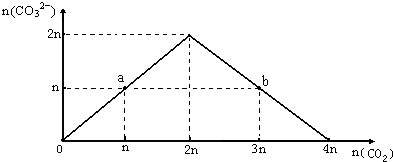 向NaOH溶液中缓慢通入CO2气体,溶液中CO32-的物质的量与通入CO2物质的量的关系图如下.下列关于图中a、b两点溶液的说法错误的是( )
向NaOH溶液中缓慢通入CO2气体,溶液中CO32-的物质的量与通入CO2物质的量的关系图如下.下列关于图中a、b两点溶液的说法错误的是( )
 向NaOH溶液中缓慢通入CO2气体,溶液中CO32-的物质的量与通入CO2物质的量的关系图如下.下列关于图中a、b两点溶液的说法错误的是( )
向NaOH溶液中缓慢通入CO2气体,溶液中CO32-的物质的量与通入CO2物质的量的关系图如下.下列关于图中a、b两点溶液的说法错误的是( )| A. | a、b溶液与同浓度盐酸完全反应时,消耗盐酸的体积相同 | |
| B. | a溶液中水的电离程度与b溶液中水的电离程度相同 | |
| C. | a、b两溶液都满足:c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-) | |
| D. | 将a、b两点混合后溶液满足:c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3) |
5.下列说法正确的是( )
| A. | 决定某化学反应反应速率的主要因素是催化剂 | |
| B. | 青霉素、橡胶、阿斯匹林全部由化学合成制得 | |
| C. | 铝有还原性,在反应中放出大量热能用来冶炼难熔金属Mn等 | |
| D. | 陶瓷品、酒精、乙烯塑料等的使用不会对环境造成污染 |
 A→J有如图所示的转化关系(反应条件、部分反应物和产物已忽略):其中A、D为银白色金属单质;B为淡黄色粉末,C为红棕色粉末,E为黑色晶体;H久置于空气中,由白色固体变为灰绿色,最终变成红褐色Ⅰ;B和I在一定条件下反应生成J,J的化学式为Na2FeO4,它能够杀菌消毒,是一种优良的净水剂.
A→J有如图所示的转化关系(反应条件、部分反应物和产物已忽略):其中A、D为银白色金属单质;B为淡黄色粉末,C为红棕色粉末,E为黑色晶体;H久置于空气中,由白色固体变为灰绿色,最终变成红褐色Ⅰ;B和I在一定条件下反应生成J,J的化学式为Na2FeO4,它能够杀菌消毒,是一种优良的净水剂.

 ,步骤Ⅱ中,通入一段时间N2的目的是避免对分解产物O2的检验产生干扰.
,步骤Ⅱ中,通入一段时间N2的目的是避免对分解产物O2的检验产生干扰.