题目内容
在0.1mol/L NH3?H2O 溶液中,下列关系正确的是( )
| A、c(NH3?H2O)>c(OH-)>c(NH4+)>c(H+) |
| B、c(NH4+)>c(NH3?H2O)>c(OH-)>c(H+) |
| C、c(NH3?H2O)>c(NH4+)=c(OH-)>c(H+) |
| D、c(NH3?H2O)>c(NH4+)>c(H+)>c(OH-) |
考点:离子浓度大小的比较
专题:
分析:NH3?H2O是弱电解质,电离出OH-而导致溶液呈碱性,则c(OH-)>c(H+),但在水溶液中电离程度很小,据此分析解答.
解答:
解:NH3?H2O是弱电解质,电离出OH-而导致溶液呈碱性,则c(OH-)>c(H+),因为水也电离出部分OH-,
所以c(OH-)>c(NH4+),但NH3?H2O在水溶液中电离程度很小,所以c(NH3?H2O)>c(OH-),所以溶液中粒子浓度大小顺序是c(NH3?H2O)>c(OH-)>c(NH4+)>c(H+),故选A.
所以c(OH-)>c(NH4+),但NH3?H2O在水溶液中电离程度很小,所以c(NH3?H2O)>c(OH-),所以溶液中粒子浓度大小顺序是c(NH3?H2O)>c(OH-)>c(NH4+)>c(H+),故选A.
点评:本题考查弱电解质的电离、离子浓度大小比较,明确一水合氨电离特点是解本题关键,不能忽略水的电离,为易错点.

练习册系列答案
 全优点练单元计划系列答案
全优点练单元计划系列答案
相关题目
下列反应的离子方程式正确的是( )
| A、铜和稀硝酸的反应:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O |
| B、盐酸加到氢氧化铁中:H++OH-═H2O |
| C、碳酸钙溶于盐酸:CO32-+2H+═H2O+CO2↑ |
| D、Ba(OH)2和(NH4)2SO4溶液混合加热:Ba2++SO42-═BaSO4↓ |
化学反应中,有时存在“一种物质过量,另一种物质仍不能完全反应”的特殊情况.下列反应中,属干这种情况的是( )
①过量锌与18mol/L的硫酸反应;
②过量氢气与少量氮气在催化剂存在下充分反应;
③浓盐酸与过量的MnO2反应;
④过量铜与浓硫酸反应;
⑤过量稀硝酸与银反应;
⑥过量稀硫酸与大块状石灰石反应.
①过量锌与18mol/L的硫酸反应;
②过量氢气与少量氮气在催化剂存在下充分反应;
③浓盐酸与过量的MnO2反应;
④过量铜与浓硫酸反应;
⑤过量稀硝酸与银反应;
⑥过量稀硫酸与大块状石灰石反应.
| A、②③④⑥ | B、②③⑤ |
| C、①④⑤ | D、①②③④⑤⑥ |
室温下某溶液中水电离出的[H+]=10-12 mol?L-1,则该溶液中一定能大量共存的离子组是( )
| A、Na+ Fe3+ Cl- I- |
| B、Ca2+、K+、Cl-、HCO3- |
| C、Mg2+ Na+ SO42-Cl- |
| D、K+ Na+ SO42-NO3- |
在下列给定条件的溶液中,一定能大量共存的离子组是( )
| A、无色溶液:Ca2+、H+、Cl-、HCO3- | ||
B、
| ||
| C、FeCl3溶液:K+、Na+、SCN-、CO32- | ||
| D、能使pH试纸呈红色的溶液:Na+、NH4+、SO32-、NO3- |
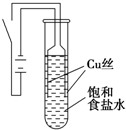 某课外兴趣小组进行电解原理的实验探究,做了如下的实验:以铜为电极,按如图所示的装置电解饱和食盐水.
某课外兴趣小组进行电解原理的实验探究,做了如下的实验:以铜为电极,按如图所示的装置电解饱和食盐水.实验现象:接通电源30s内,阳极附近出现白色浑浊,之后变成橙黄色浑浊,此时测定溶液的pH约为10.一段时间后,试管底部聚集大量红色沉淀,溶液仍为无色.
查阅资料:
| 物质 | 氯化铜 | 氧化亚铜 | 氢氧化亚铜(不稳定) | 氯化亚铜 |
| 颜色 | 固体呈棕色,浓溶液呈绿色,稀溶液呈蓝色 | 红色 | 橙黄色 | 白色 |
| A、反应结束后最终溶液呈碱性 |
| B、阴极上发生的电极反应为:2H2O+2e?═H2↑+2OH? |
| C、电解过程中氯离子移向阳极 |
| D、试管底部红色的固体具有还原性 |