题目内容
9.用如图所示装置电解氯化钠溶液(X、Y 是碳棒).下列判断正确的是( )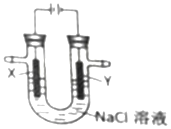
| A. | X电极为阴极 | B. | Y电极为负极 | ||
| C. | X电极表面发生氧化反应 | D. | Y电极表面有氯气生成 |
分析 电解饱和食盐水,X为阳极,发生氧化反应生成氯气,Y为阴极,发生还原反应生成氢气,以此解答该题.
解答 解:A.X连接电源的正极,为电解池的阳极,故A错误;
B.Y为阴极,故B错误;
C.X为阳极,发生氧化反应,氯离子被氧化,故C正确;
D.Y为阴极,表面生成氢气,故D错误.
故选C.
点评 本题考查电解池的工作原理,为高频考点,侧重于学生的分析能力的考查,难度不大,注意把握电极和反应类型的判断,把握电极反应,难度不大.

练习册系列答案
相关题目
1.用下列实验装置完成对应的实验,不能达到实验目的是( )
| A. | 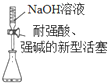 量取10.00mLNaOH溶液 | |
| B. | 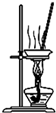 蒸干氯化铜溶液制CuCl2•2H2O | |
| C. | 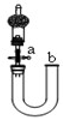 关闭活塞a,从b处加水,以检查装置的气密性 | |
| D. | 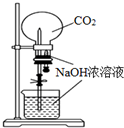 用CO2做喷泉实验 |
2.化学与生产、生活、社会密切相关,下列说法错误的是( )
| A. | 氯气处理饮用水,在冬季的杀菌效果比在夏季好 | |
| B. | 中国古代利用明矾溶液的酸性来清除铜镜表面的铜锈 | |
| C. | 食盐、漂白粉均可以将某些病毒氧化而达到消毒的目的 | |
| D. | 白葡萄酒含维生素C等多种维生素,通常添加微量SO2,以防止营养成分被氧化 |
18.下列说法不正确的是( )
| A. | 生铁、不锈钢和黄铜都属于合金 | |
| B. | 淀粉、油脂和蛋白质都属于天然高分子化合物 | |
| C. | 水泥、玻璃和陶瓷都属于无机非金属材料 | |
| D. | 天然气、液化石油气和汽油的主要成分都属于烃类 |
5.下列叙述正确的是( )
(1)已知NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(1)△h=-57.3KJ/mol,则含40.0gNaOH的稀溶液与稀醋酸完全中和,放出57.3KJ的热量
(2)向沉淀溶液中加入稀H2SO4加热几分钟,冷却后再加入新制Cu(OH)2悬浊液,加热,无砖红色沉淀生成,说明沉淀没有水解生成葡萄糖
(3)同一主族的元素,原子半径越大,其单质的熔点不一定越高
(4)乙酸乙酯在NaOH溶液(H218O)中水解产物为CH3CO18ONa和CH3CH2OH
(5)pH=4.3的物质的量的CH3COOH与CH3COONa混合溶液中:c(Na+)<c(CH3COO-)
(6)在AgCl的沉淀溶解平衡体系中,加入蒸馏水,Ksp(AgCl)增大( )
(1)已知NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(1)△h=-57.3KJ/mol,则含40.0gNaOH的稀溶液与稀醋酸完全中和,放出57.3KJ的热量
(2)向沉淀溶液中加入稀H2SO4加热几分钟,冷却后再加入新制Cu(OH)2悬浊液,加热,无砖红色沉淀生成,说明沉淀没有水解生成葡萄糖
(3)同一主族的元素,原子半径越大,其单质的熔点不一定越高
(4)乙酸乙酯在NaOH溶液(H218O)中水解产物为CH3CO18ONa和CH3CH2OH
(5)pH=4.3的物质的量的CH3COOH与CH3COONa混合溶液中:c(Na+)<c(CH3COO-)
(6)在AgCl的沉淀溶解平衡体系中,加入蒸馏水,Ksp(AgCl)增大( )
| A. | (1)(2)(5)(6) | B. | (3)(4)(5) | C. | (2)(3)(5)(6) | D. | (1)(2)(3)(4)(5) |
14.下列实验操作、现象和结论均正确的是( )
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 将某有机物与溴的四氯化碳溶液混合 | 溶液褪色 | 该有机物中必定含有碳碳双键 |
| B | 向亚硫酸钠溶液中滴加硝酸钡和稀硝酸 | 产生白色沉淀 | 亚硫酸钠溶液已变质 |
| C | 向酸性高锰酸钾溶液中滴加双氧水 | 紫色褪去,产生气泡 | H2O2具有还原性 |
| D | 向油脂皂化反应后的溶液中滴入酚酞 | 溶液不变红 | 油脂已经完全皂化 |
| A. | A | B. | B | C. | C | D. | D |
20. 汽车尾气是导致雾霾天气的重要源头之一,其含有的NO(g)和CO(g)在一定温度和催化剂条件下可发生反应.
汽车尾气是导致雾霾天气的重要源头之一,其含有的NO(g)和CO(g)在一定温度和催化剂条件下可发生反应.
(一)已知:反应l:N2(g)+O2(g)═2NO(g)△H1 K1
反应2:CO(g)+$\frac{1}{2}$O2(g)═CO2 (g)△H2 K2
反应3:2NO(g)+2CO(g)═N2(g)+CO2(g)△H3 K3
则反应3的焓变△H3=2△H2-△H1(用△H1和△H2表示) 平衡常数K3=$\frac{{{K}_{2}}^{2}}{{K}_{1}}$(用K1和K2表示).
(二)向1.0L恒容密闭容器中,充入N2O(g)和CO(g),可发生如下反应:N2O(g)+CO(g)?N2(g)+CO2(g),所得实验数据如表:
上述实验编号①中,若10min时测得n(N2)=0.12mol,则0至10min内,用CO2表示的平均反应速率以v(CO2)=0.012mol•(L•min)-1;
(2)500℃时,欲使N2O的平衡转化率a(N2O)≥80%,则起始时n(N2O):n(CO)≤1:4.
(3)上述实验编号④达平衡时,b<0.24(填“>”、“<”或“=”),原因是该反应△H<0,升高温度,平衡向逆反应方向移动,故b<0.24mol.
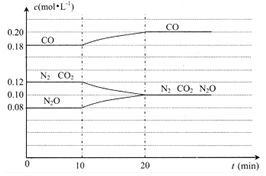
(4)N2O(g)+CO(g)?N2(g)+CO2(g)的反应体系达到平衡后,各物质的浓度在不同条件下的变化情况如如图所示:
①若在第10min仅改变了一个条件,第20min时是在新条件下达到新的平衡状态,则第10min 时改变的条件可能是升温;
②比较CO在第5min和第25min时速率的大小v(5)<v(25)(填”>”、“<”或“=”),你判断的理由是相对于第5min而言,在第10min时升高了温度,且浓度增加了,在其它条件不变时,速率会变快.
 汽车尾气是导致雾霾天气的重要源头之一,其含有的NO(g)和CO(g)在一定温度和催化剂条件下可发生反应.
汽车尾气是导致雾霾天气的重要源头之一,其含有的NO(g)和CO(g)在一定温度和催化剂条件下可发生反应.(一)已知:反应l:N2(g)+O2(g)═2NO(g)△H1 K1
反应2:CO(g)+$\frac{1}{2}$O2(g)═CO2 (g)△H2 K2
反应3:2NO(g)+2CO(g)═N2(g)+CO2(g)△H3 K3
则反应3的焓变△H3=2△H2-△H1(用△H1和△H2表示) 平衡常数K3=$\frac{{{K}_{2}}^{2}}{{K}_{1}}$(用K1和K2表示).
(二)向1.0L恒容密闭容器中,充入N2O(g)和CO(g),可发生如下反应:N2O(g)+CO(g)?N2(g)+CO2(g),所得实验数据如表:
| 实验编号 | 温度/℃ | 起始时物质的量/mol | 平衡时物质的量/mol | |
| n(N2O) | n(CO) | n(CO2) | ||
| ① | 400 | 0.20 | 0.30 | 0.14 |
| ② | 500 | 0.10 | 0.40 | 0.080 |
| ③ | 500 | 0.30 | 0.20 | A |
| ④ | 600 | 0.60 | 0.40 | B |
(2)500℃时,欲使N2O的平衡转化率a(N2O)≥80%,则起始时n(N2O):n(CO)≤1:4.
(3)上述实验编号④达平衡时,b<0.24(填“>”、“<”或“=”),原因是该反应△H<0,升高温度,平衡向逆反应方向移动,故b<0.24mol.
(4)N2O(g)+CO(g)?N2(g)+CO2(g)的反应体系达到平衡后,各物质的浓度在不同条件下的变化情况如如图所示:
①若在第10min仅改变了一个条件,第20min时是在新条件下达到新的平衡状态,则第10min 时改变的条件可能是升温;
②比较CO在第5min和第25min时速率的大小v(5)<v(25)(填”>”、“<”或“=”),你判断的理由是相对于第5min而言,在第10min时升高了温度,且浓度增加了,在其它条件不变时,速率会变快.
17.设NA为阿伏加德罗常数的值.下列叙述正确的是( )
| A. | 等物质的量的NaN3和Na2O2中所含阴离子数均为NA | |
| B. | 电解精炼铜时,若阳极质量减少6.4g,则电路中转移电子数为0.2NA | |
| C. | 标准状况下,将3.36LCl2通入1L 0.2mol•L-1FeBr2溶液中,被氧化的Br-数目为0.1NA | |
| D. | 标准状况下,11g由${\;}_{1}^{3}$H和${\;}_{8}^{16}$O组成的超重水中,中子数和电子数之和为10NA |
