题目内容
20. 汽车尾气是导致雾霾天气的重要源头之一,其含有的NO(g)和CO(g)在一定温度和催化剂条件下可发生反应.
汽车尾气是导致雾霾天气的重要源头之一,其含有的NO(g)和CO(g)在一定温度和催化剂条件下可发生反应.(一)已知:反应l:N2(g)+O2(g)═2NO(g)△H1 K1
反应2:CO(g)+$\frac{1}{2}$O2(g)═CO2 (g)△H2 K2
反应3:2NO(g)+2CO(g)═N2(g)+CO2(g)△H3 K3
则反应3的焓变△H3=2△H2-△H1(用△H1和△H2表示) 平衡常数K3=$\frac{{{K}_{2}}^{2}}{{K}_{1}}$(用K1和K2表示).
(二)向1.0L恒容密闭容器中,充入N2O(g)和CO(g),可发生如下反应:N2O(g)+CO(g)?N2(g)+CO2(g),所得实验数据如表:
| 实验编号 | 温度/℃ | 起始时物质的量/mol | 平衡时物质的量/mol | |
| n(N2O) | n(CO) | n(CO2) | ||
| ① | 400 | 0.20 | 0.30 | 0.14 |
| ② | 500 | 0.10 | 0.40 | 0.080 |
| ③ | 500 | 0.30 | 0.20 | A |
| ④ | 600 | 0.60 | 0.40 | B |
(2)500℃时,欲使N2O的平衡转化率a(N2O)≥80%,则起始时n(N2O):n(CO)≤1:4.
(3)上述实验编号④达平衡时,b<0.24(填“>”、“<”或“=”),原因是该反应△H<0,升高温度,平衡向逆反应方向移动,故b<0.24mol.
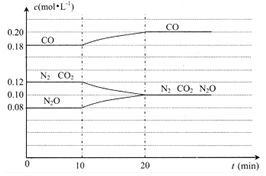
(4)N2O(g)+CO(g)?N2(g)+CO2(g)的反应体系达到平衡后,各物质的浓度在不同条件下的变化情况如如图所示:
①若在第10min仅改变了一个条件,第20min时是在新条件下达到新的平衡状态,则第10min 时改变的条件可能是升温;
②比较CO在第5min和第25min时速率的大小v(5)<v(25)(填”>”、“<”或“=”),你判断的理由是相对于第5min而言,在第10min时升高了温度,且浓度增加了,在其它条件不变时,速率会变快.
分析 (一)反应l:N2(g)+O2(g)═2NO(g)△H1 K1
反应2:CO(g)+$\frac{1}{2}$O2(g)═CO2 (g)△H2 K2
反应3:2NO(g)+2CO(g)═N2(g)+CO2(g)△H3 K3
结合盖斯定律计算反应2×2-反应1得到;平衡常数 K=$\frac{生成物平衡浓度幂次方乘积}{反应物平衡浓度幂次方乘积}$,写出平衡常数表达式计算得到K3;
(二)(1)若10min时测得n(N2)=0.12mol,
N2O(g)+CO(g)?N2(g)+CO2(g),
起始量(mol) 0.2 0.3 0 0
变化量(mol) 0.12 0.12 0.12 0.12
平衡量(mol) 0.08 0.18 0.12 0.12
则0至10min内,用CO2表示的平均反应速率以v(CO2)=$\frac{△c}{△t}$;
(2)结合三行计算列式计算,500℃时,欲使N2O的平衡转化率a(N2O)≥80%,
N2O(g)+CO(g)?N2(g)+CO2(g),
起始量(mol) 0.1 0.4 0 0
变化量(mol) 0.08 0.08 0.08 0.08
平衡量(mol) 0.02 0.12 0.08 0.08
欲使N2O的平衡转化率a(N2O)≥80%,两种反应物增加一种会提高另一种转化率;
(3)实验②③温度相同,平衡常数相同,结合平衡常数计算A的值,实验④起始量增大一倍,反应前后气体体积不变,温度不变时B=2A;图表数据计算可知温度升高,平衡逆向进行,正反应为放热反应,升温平衡逆向进行;
(4)①反应为放热反应,图象可知10min改变条件,平衡逆向进行,说明为升高温度;
②图象可知5min达到平衡状态,25min又达到平衡状态,此时CO浓度增大,反应速率增大.
解答 解:(一)反应l:N2(g)+O2(g)═2NO(g)△H1 K1
反应2:CO(g)+$\frac{1}{2}$O2(g)═CO2 (g)△H2 K2
反应3:2NO(g)+2CO(g)═N2(g)+CO2(g)△H3 K3
结合盖斯定律计算反应2×2-反应1得到2NO(g)+2CO(g)═N2(g)+CO2(g)△H3=2△H2-△H1 ,
K1=$\frac{{c}^{2}(NO)}{c({N}_{2})c({O}_{2})}$,K2=$\frac{c(C{O}_{2})}{c(CO){c}^{\frac{1}{2}}({O}_{2})}$,
K3=$\frac{c(C{O}_{2})c({N}_{2})}{{c}^{3}(NO){c}^{2}(CO)}$=$\frac{{{K}_{2}}^{2}}{{K}_{1}}$,
故答案为:2△H2-△H1;$\frac{{{K}_{2}}^{2}}{{K}_{1}}$;
(二)(1)若10min时测得n(N2)=0.12mol,
N2O(g)+CO(g)?N2(g)+CO2(g),
起始量(mol) 0.2 0.3 0 0
变化量(mol) 0.12 0.12 0.12 0.12
平衡量(mol) 0.08 0.18 0.12 0.12
则0至10min内,用CO2表示的平均反应速率以v(CO2)=$\frac{△c}{△t}$=$\frac{\frac{0.12mol}{1L}}{10min}$=0.012mol•(L•min)-1,
故答案为:0.012mol•(L•min)-1;
(2)结合三行计算列式计算,500℃时,欲使N2O的平衡转化率a(N2O)≥80%,
N2O(g)+CO(g)?N2(g)+CO2(g),
起始量(mol) 0.2 0.3 0 0
变化量(mol) 0.12 0.12 0.12 0.12
平衡量(mol) 0.08 0.18 0.12 0.12
欲使N2O的平衡转化率a(N2O)≥80%,两种反应物增加一种会提高另一种转化率,所以起始时n(N2O):n(CO)≤1:4,
故答案为:l:4;
(3)实验②③温度相同,平衡常数相同,实验②平衡常数计算,
N2O(g)+CO(g)?N2(g)+CO2(g),
起始量(mol) 0.1 0.4 0 0
变化量(mol) 0.08 0.08 0.08 0.08
平衡量(mol) 0.02 0.32 0.08 0.08
反应前后气体体积不变,可以用物质的量代替平衡浓度计算平衡常数K=$\frac{0.08×0.08}{0.02×0.32}$=1
400°C平衡常数计算
N2O(g)+CO(g)?N2(g)+CO2(g),
起始量(mol) 0.2 0.3 0 0
变化量(mol) 0.14 0.14 0.14 0.14
平衡量(mol) 0.06 0.16 0.14 0.14
K=$\frac{0.14×0.14}{0.16×0.06}$=$\frac{49}{24}$>1,说明温度越高平衡逆向进行,正反应为放热反应,
结合500°C平衡常数计算A的值,
N2O(g)+CO(g)?N2(g)+CO2(g),
起始量(mol) 0.3 0.2 0 0
变化量(mol) x x x x
平衡量(mol) 0.3-x 0.2-x x x
$\frac{{x}^{2}}{(0.3-x)(0.2-x)}$=1
x=0.12
实验④起始量增大一倍,反应前后气体体积不变,温度不变时B=2A=0.24;图表数据和计算可知温度升高,平衡逆向进行,正反应为放热反应,升温平衡逆向进行,b<0.24mol,
故答案为:<;该反应△H<O,升高温度,平衡向逆反应方向移动,故b<0.24mol;
(4)①若在第10min仅改变了一个条件,第20min时是在新条件下达到新的平衡状态,过程中反应物浓度增大,生成物浓度减小,说明平衡逆向进行,反应是放热反应,改变的条件可以是升高温度偏高逆向进行,
故答案为:升温;
②图象分析比较CO在第5min和第25min时速率的大小v(5)<v(25),判断的理由是:相对于第5min而言,在第10min时升高了温度,且浓度增加了,在其它条件不变时,速率会变快,
故答案为:<;相对于第5min而言,在第10min时升高了温度,且浓度增加了,在其它条件不变时,速率会变快.
点评 本题考查了热化学方程式书写、平衡常数计算、平衡常数影响因素分析,主要是图象的理解应用和平衡常数随温度变化的特征性质,掌握基础是解题关键,题目难度中等.


| A. | b 电极的质量不变 | B. | b 电极是该装置的正极 | ||
| C. | a 电极上发生氧化反应 | D. | 电子由 b 电极经溶液流向 a 电极 |
| A. | 2Al2O3+C$\frac{\underline{\;高温\;}}{\;}$4Al+3CO2↑ | B. | MgO+H2$\frac{\underline{\;\;△\;\;}}{\;}$Mg+H2O | ||
| C. | 2HgO$\frac{\underline{\;电解\;}}{\;}$2Hg+O2↑ | D. | Fe3O4+4CO$\frac{\underline{\;高温\;}}{\;}$3Fe+4CO2↑ |
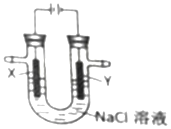
| A. | X电极为阴极 | B. | Y电极为负极 | ||
| C. | X电极表面发生氧化反应 | D. | Y电极表面有氯气生成 |
| A. | 9 种 | B. | 10种 | C. | 11 种 | D. | 12 种 |
| A. | 12gC与16gO2所具有的总能量一定高于28gCO所具有的能量 | |
| B. | 56gCO所具有的能量大于88gCO2所具有的能量 | |
| C. | 12gC和32gO2所具有的总能量大于44gCO2所具有的能量 | |
| D. | 将一定质量的碳燃烧,生成CO2比生成CO时放出的热量多 |
| A. | (1+α)n | B. | $\frac{(1+α)n}{1-α}$ | C. | $\frac{(1-α)n}{1+α}$ | D. | (1+2α)n |
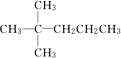 ,该烷烃分子的名称2,2-二甲基戊烷.
,该烷烃分子的名称2,2-二甲基戊烷.