题目内容
17.设NA为阿伏加德罗常数的值.下列叙述正确的是( )| A. | 等物质的量的NaN3和Na2O2中所含阴离子数均为NA | |
| B. | 电解精炼铜时,若阳极质量减少6.4g,则电路中转移电子数为0.2NA | |
| C. | 标准状况下,将3.36LCl2通入1L 0.2mol•L-1FeBr2溶液中,被氧化的Br-数目为0.1NA | |
| D. | 标准状况下,11g由${\;}_{1}^{3}$H和${\;}_{8}^{16}$O组成的超重水中,中子数和电子数之和为10NA |
分析 A.1molNaN3和Na2O2中都含有1mol阴离子,缺少物质的量数值,无法计算含有阴离子数目;
B.粗铜中含有杂质铁、锌,电解过程中铁、锌杂质优先放电;
C.还原性:Fe2+>Br-,氯气不足时亚铁离子优先被氧化,剩余的氯气再氧化溴离子;
D.31H和168O组成的超重水为31H2168O,摩尔质量为22g/mol,其分子中含有12个中子.
解答 解:A.没有告诉NaN3和Na2O2的物质的量,无法计算含有阴离子数目,故A错误;
B.电解过程中,活泼性较强的杂质铁、锌等金属先放电,则阳极减少6.4g时,转移的电子不一定为0.2mol,转移电子数不一定为0.2NA,故B错误;
C.标准状况下3.36LCl2的物质的量为0.15mol,1L 0.2mol•L-1FeBr2溶液中含有溴化亚铁的物质的量为0.2mol,亚铁离子还原性较强,优先被氧化,0.2mol亚铁离子完全反应消耗0.1mol氯气,剩余的0.05mol氯气能够氧化0.1mol溴离子,被氧化的Br-数目为0.1NA,故C正确;
D.11g31H和168O组成的超重水31H2168O的物质的量为:$\frac{11g}{22g/mol}$=0.5mol,31H2168O分子中质子、中子数之和=质量数=6+16=22,则0.5mol超重水中含有中子数和电子数之和为11mol,数目为11NA,故D错误;
故选C.
点评 本题考查阿伏加德罗常数的综合应用,题目难度中等,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,明确分子、原子、原子核内质子中子及核外电子的构成关系;试题有利于培养学生的逻辑推理能力,提高学生的灵活应用能力.

练习册系列答案
 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案
相关题目
10. 常温下向某浓度的氯水中逐滴滴入Na2SO3溶液,无气体逸出,溶液pH变化如图所示,下列关系错误的是( )
常温下向某浓度的氯水中逐滴滴入Na2SO3溶液,无气体逸出,溶液pH变化如图所示,下列关系错误的是( )
 常温下向某浓度的氯水中逐滴滴入Na2SO3溶液,无气体逸出,溶液pH变化如图所示,下列关系错误的是( )
常温下向某浓度的氯水中逐滴滴入Na2SO3溶液,无气体逸出,溶液pH变化如图所示,下列关系错误的是( )| A. | a点:c(H+)>c(Cl-)>c(ClO-) | |
| B. | b点:$\frac{1}{2}$ c(Cl-)=c(SO42-)=0.005 mol•L-1 | |
| C. | c点:c(Na+)=2c(HSO3-)+2c(SO32-)+2c(SO42-) | |
| D. | d点:c(Na+)=c(Cl-)+2c(SO32-)+c(HSO3-)+2c(SO42-) |
9.用如图所示装置电解氯化钠溶液(X、Y 是碳棒).下列判断正确的是( )
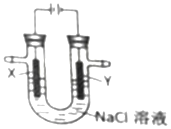

| A. | X电极为阴极 | B. | Y电极为负极 | ||
| C. | X电极表面发生氧化反应 | D. | Y电极表面有氯气生成 |
5.2C+O2$\frac{\underline{\;点燃\;}}{\;}$2CO和2CO+O2$\frac{\underline{\;点燃\;}}{\;}$2CO2都是放热反应.下列说法不正确的是( )
| A. | 12gC与16gO2所具有的总能量一定高于28gCO所具有的能量 | |
| B. | 56gCO所具有的能量大于88gCO2所具有的能量 | |
| C. | 12gC和32gO2所具有的总能量大于44gCO2所具有的能量 | |
| D. | 将一定质量的碳燃烧,生成CO2比生成CO时放出的热量多 |
12.室温下,某醋酸溶液的电离度为α,电离平衡时溶液中含CH3COOH分子为n mol,此时,溶液中的CH3COOH、H+、CH3COO-总物质的量为( )
| A. | (1+α)n | B. | $\frac{(1+α)n}{1-α}$ | C. | $\frac{(1-α)n}{1+α}$ | D. | (1+2α)n |
2. 向甲、乙、丙三个恒容密闭容器中分别充入一定量的A和B,发生反应:A(g)+xB(g)?2C(g).相关数据如表,反应过程中C的浓度随时间变化关系如图.下列说法正确的是( )
向甲、乙、丙三个恒容密闭容器中分别充入一定量的A和B,发生反应:A(g)+xB(g)?2C(g).相关数据如表,反应过程中C的浓度随时间变化关系如图.下列说法正确的是( )
 向甲、乙、丙三个恒容密闭容器中分别充入一定量的A和B,发生反应:A(g)+xB(g)?2C(g).相关数据如表,反应过程中C的浓度随时间变化关系如图.下列说法正确的是( )
向甲、乙、丙三个恒容密闭容器中分别充入一定量的A和B,发生反应:A(g)+xB(g)?2C(g).相关数据如表,反应过程中C的浓度随时间变化关系如图.下列说法正确的是( )| 容器 | 甲 | 乙 | 丙 |
| 容积 | 0.5L | 0.5L | 1.0L |
| 温度/℃ | T1 | T2 | T2 |
| 反应物 起始量 | 1.5 mol A 0.5 mol B | 1.5 mol A 0.5 mol B | 6 mol A 2 mol B |
| A. | T1>T2,x=1 | |
| B. | T2℃时,该反应的平衡常数为0.8 | |
| C. | A的平衡转化率a(甲):a(乙)=2:3 | |
| D. | 15~20min内C的平均反应速率v(乙)<v(丙) |
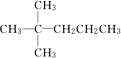 ,该烷烃分子的名称2,2-二甲基戊烷.
,该烷烃分子的名称2,2-二甲基戊烷. 2SO3(g)的化学反应速率,其中表示该反应进行的最快的是( )
2SO3(g)的化学反应速率,其中表示该反应进行的最快的是( )