题目内容
5.下列叙述正确的是( )(1)已知NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(1)△h=-57.3KJ/mol,则含40.0gNaOH的稀溶液与稀醋酸完全中和,放出57.3KJ的热量
(2)向沉淀溶液中加入稀H2SO4加热几分钟,冷却后再加入新制Cu(OH)2悬浊液,加热,无砖红色沉淀生成,说明沉淀没有水解生成葡萄糖
(3)同一主族的元素,原子半径越大,其单质的熔点不一定越高
(4)乙酸乙酯在NaOH溶液(H218O)中水解产物为CH3CO18ONa和CH3CH2OH
(5)pH=4.3的物质的量的CH3COOH与CH3COONa混合溶液中:c(Na+)<c(CH3COO-)
(6)在AgCl的沉淀溶解平衡体系中,加入蒸馏水,Ksp(AgCl)增大( )
| A. | (1)(2)(5)(6) | B. | (3)(4)(5) | C. | (2)(3)(5)(6) | D. | (1)(2)(3)(4)(5) |
分析 (1)醋酸为弱酸,电离吸热;
(2)淀粉水解生成葡萄糖,葡萄糖与氢氧化铜浊液应在碱性条件下反应;
(3)同一主族的元素,如为金属单质,原子半径越大,单质的熔点越低;
(4)乙酸和乙醇发生酯化反应时“酸脱羟基醇脱氢”,乙酸乙酯的水解为酯化反应的逆反应;
(5)CH3COONa与CH3COOH的混合溶液中,根据电荷守恒c(CH3COO?)+c(OH?)=c(H+)+c(Na+)结合酸碱性判断c(CH3COO?)、c(Na+)相对大小;
(6)KSP只与温度有关,与浓度无关.
解答 解:(1)醋酸为弱酸,电离吸热,则含40.0g NaOH的稀溶液与稀醋酸完全中和,放出热量小于57.3kJ,故错误;
(2)淀粉在酸性条件下水解生成葡萄糖,葡萄糖与氢氧化铜浊液应在碱性条件下反应,反应后的溶液应先加入氢氧化钠溶液调节溶液至碱性,故错误;
(3)同一主族的元素,如为金属单质,原子半径越大,单质的熔点越低,故正确;
(4)乙酸乙酯在氢氧化钠的H218O中水解生成CH3CO18ONa和C2H5OH,故正确;
(5)CH3COONa与CH3COOH的混合溶液的pH=4.3<7,则:c(OH?)<c(H+),根据电荷守恒c(CH3COO?)+c(OH?)=c(H+)+c(Na+)可得:c(CH3COO?)>c(Na+),故正确;
(6)KSP只与温度有关,与浓度无关,所以在氯化银的沉淀溶解平衡体系中加入蒸馏水,氯化银的Ksp不变,故错误.
故选B.
点评 本题考查较为综合,涉及弱电解质的电离、淀粉的水解、元素周期率、乙酸乙酯的性质以及Ksp的判断等知识,为高频考点,侧重于双基的考查,注意相关基础知识的学习,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
15.对于反应N2(g)+3H2(g)?2NH3(g)△H<0,下列说法正确的是( )
| A. | 升高温度,反应放出热量增多 | |
| B. | 恒温恒容下,向达平衡后容器中通入惰性气体,平衡向正反方向移动 | |
| C. | 工业合成氨时采用较高的温度有利于提高生产效率 | |
| D. | 工业合成氨时使用铁作催化剂,有利于提高转化率 |
17.某结晶水合物失去全部结晶水后得到固体物质x,当压强一定时,x在水中的溶解度随温度升高而增大,在t1℃,t2℃,t3℃时,X的溶解度分别是S1g,S2g,S3g,若对x的水溶液进行以下实验.结论正确的是( )
| A. | 将一定质量t1℃的饱和溶液升温后,溶液浓度小于$\frac{{S}_{1}}{100+{S}_{1}}$×100% | |
| B. | 把t1℃时的饱和溶液升温到t2℃,需加入x固体(S2-S1)g才饱和 | |
| C. | 把t1℃和t2℃时x的两种饱和溶液各a g分别降温至t℃,所得溶液浓度相等 | |
| D. | 把t3℃时的饱和溶液(100+S3)g冷却到t2℃时,一定析出固体(S3-S2)g |
13.下列金属冶炼的反应原理正确的是( )
| A. | 2Al2O3+C$\frac{\underline{\;高温\;}}{\;}$4Al+3CO2↑ | B. | MgO+H2$\frac{\underline{\;\;△\;\;}}{\;}$Mg+H2O | ||
| C. | 2HgO$\frac{\underline{\;电解\;}}{\;}$2Hg+O2↑ | D. | Fe3O4+4CO$\frac{\underline{\;高温\;}}{\;}$3Fe+4CO2↑ |
20.下列关于苯和甲苯的说法正确的是( )
| A. | 甲苯苯环上的一个氢原子被-C3H7取代得到的有机物结构共有3种 | |
| B. | 等质量的苯和甲苯分别完全燃烧后,生成的CO2与消耗的O2的物质的量均相同 | |
| C. | 苯和甲苯均能发生取代反应和加成反应 | |
| D. | 间二甲苯只有一种结构可说明苯分子中不存在碳碳单键与碳碳双键交替的结构 |
9.用如图所示装置电解氯化钠溶液(X、Y 是碳棒).下列判断正确的是( )
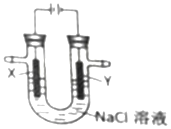

| A. | X电极为阴极 | B. | Y电极为负极 | ||
| C. | X电极表面发生氧化反应 | D. | Y电极表面有氯气生成 |
16.不考虑羟基与氯原子在同一个碳原子上时,有机物C4H9C1O的同分异构体中能与Na反应放出氢气的共有(不含立体异构)( )
| A. | 9 种 | B. | 10种 | C. | 11 种 | D. | 12 种 |
12.室温下,某醋酸溶液的电离度为α,电离平衡时溶液中含CH3COOH分子为n mol,此时,溶液中的CH3COOH、H+、CH3COO-总物质的量为( )
| A. | (1+α)n | B. | $\frac{(1+α)n}{1-α}$ | C. | $\frac{(1-α)n}{1+α}$ | D. | (1+2α)n |
 2H++SO
2H++SO


 的名称3-甲基-1-丁醇
的名称3-甲基-1-丁醇