题目内容
下列实验结论或操作、生产方法,准确合理的是( )
| A、某钠盐溶于盐酸产生能使澄清石灰水变浑浊的无色无味气体,说明该钠盐是Na2CO3 |
| B、用饱和Na2CO3溶液除去CO2中混有的HCl |
| C、工业上常采用电解熔融MgO的方法制取金属镁 |
| D、除去MgCl2溶液中少量FeCl3可向其中加入足量Mg(OH)2粉末,充分搅拌后过滤 |
考点:物质的检验和鉴别的基本方法选择及应用,电解原理,物质的分离、提纯和除杂
专题:实验评价题
分析:A、碳酸氢钠与HCl反应也生成二氧化碳;
B、碳酸钠能与二氧化碳反应;
C、工业上常采用电解熔融MgCl2制镁;
D、FeCl3易水解生成氢氧化铁沉淀.
B、碳酸钠能与二氧化碳反应;
C、工业上常采用电解熔融MgCl2制镁;
D、FeCl3易水解生成氢氧化铁沉淀.
解答:
解:A、碳酸氢钠与HCl反应也生成二氧化碳,则;某钠盐溶于盐酸产生能使澄清石灰水变浑浊的无色无味气体,说明该钠盐是Na2CO3或NaHCO3,故A错误;
B、碳酸钠能与二氧化碳反应,应该用用饱和NaHCO3溶液除去CO2中混有的HCl,故B错误;
C、工业上常采用电解熔融MgCl2制镁,MgO熔点很高,会增加生成成本,故C错误;
D、FeCl3易水解生成氢氧化铁沉淀,则MgCl2溶液中含有少量FeCl3可向其中加入足量Mg(OH)2粉末,pH增大,FeCl3会水解生成氢氧化铁沉淀,过滤即可除去,故D正确.
故选D.
B、碳酸钠能与二氧化碳反应,应该用用饱和NaHCO3溶液除去CO2中混有的HCl,故B错误;
C、工业上常采用电解熔融MgCl2制镁,MgO熔点很高,会增加生成成本,故C错误;
D、FeCl3易水解生成氢氧化铁沉淀,则MgCl2溶液中含有少量FeCl3可向其中加入足量Mg(OH)2粉末,pH增大,FeCl3会水解生成氢氧化铁沉淀,过滤即可除去,故D正确.
故选D.
点评:本题考查了物质的检验鉴别、除杂质、金属的冶炼等,题目难度不大,把握物质的性质是解题的关键.

练习册系列答案
相关题目
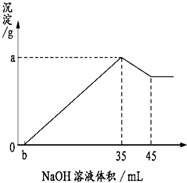 准确称取6克铝土矿样品(含Al2O3、Fe2O3、SiO2)加入100mL硫酸溶液,充分反应后,
准确称取6克铝土矿样品(含Al2O3、Fe2O3、SiO2)加入100mL硫酸溶液,充分反应后,向滤液中加入10mol/L NaOH溶液,产生沉淀的质量与加入NaOH溶液的体积关系如图所示,求所用硫酸溶液的物质的量浓度( )
| A、1.75 mol/L |
| B、3.5 mol/L |
| C、2.25 mol/L |
| D、无法计算 |
10mL 1mol?L-1盐酸与一小块大理石的化学反应:CaCO3+2HCl═CaCl2+CO2↑+H2O,下列措施能使化学反应速率提高的是( )
| A、加入一定量的CaCl2 |
| B、加入5 mL 1.5 mol?L-1盐酸 |
| C、加入15 mL 0.5 mol?L-1盐酸 |
| D、加入5 mL H2O |
根据右面的能量变化示意图,确定下列选项中正确的是( )


| A、2 A(g)+B(g)═2 C(g)△H<0 |
| B、2 A(g)+B(g)═2 C(g)△H>0 |
| C、2 C(g)═2A(g)+B(g) H>0 |
| D、2C(g)═2 A(g)+B(g) H<0 |
 已知:①反应2C+O2=2CO 的能量变化如图所示.②含5.6g KOH的稀溶液与0.5L 0.1mol/L的H2SO4溶液反应放出5.73kJ的热量.下列说法正确的是( )
已知:①反应2C+O2=2CO 的能量变化如图所示.②含5.6g KOH的稀溶液与0.5L 0.1mol/L的H2SO4溶液反应放出5.73kJ的热量.下列说法正确的是( )| A、2mol C(s)与足量O2(g)反应生成CO2(g),放出的热量大于221 kJ |
| B、12g C(s)与一定量O2(g)反应生成14 g CO(g),放出的热量为110.5 kJ |
| C、该反应的热化学方程式是:2C(s)+O2(g)=2CO(g)△H=-110.5 kJ/mol |
| D、表示中和热的热化学方程式2KOH (aq)+H2SO4 (aq)=K2SO4(aq)+2H2O (l)△H=-114.6 kJ/mol |
某有机物在氧气中完全燃烧,得到CO2和H2O,说明该有机物中( )
| A、一定含有碳、氢元素,不含有氧元素 |
| B、一定含有碳、氢、氧元素 |
| C、一定含有碳、氢元素,不一定含有氧元素 |
| D、无法确定 |
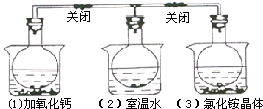 如图所示,三个烧瓶中分别充满NO2气体,并分别放置在盛有下列物质的烧杯中(烧杯内有水):在(1)中加入CaO,在(2)中不加其他任何物质,在(3)中加入NH4Cl晶体,发现(1)中红棕色变深,(3)中红棕色变浅,下列叙述正确的是( )
如图所示,三个烧瓶中分别充满NO2气体,并分别放置在盛有下列物质的烧杯中(烧杯内有水):在(1)中加入CaO,在(2)中不加其他任何物质,在(3)中加入NH4Cl晶体,发现(1)中红棕色变深,(3)中红棕色变浅,下列叙述正确的是( )| A、烧瓶(3)中气体的压强增大 |
| B、NH4Cl溶于水时放出热量 |
| C、烧瓶(1)中平衡时混合气体的平均相对分子质量增大 |
| D、2NO2?N2O4是放热反应 |