题目内容
13.Zn+H2SO4=ZnSO4+H2↑ 氧化剂H2SO4还原剂Zn.分析 在反应Zn+H2SO4═ZnSO4+H2↑中,Zn元素的化合价由0升高到+2价,则Zn为还原剂,H元素的化合价由+1降低到0价,则H2SO4为氧化剂,由此分析解答.
解答 解:在反应Zn+H2SO4═ZnSO4+H2↑中,Zn元素的化合价由0升高到+2价,则Zn为还原剂,H元素的化合价由+1降低到0价,则H2SO4为氧化剂,
故答案为:H2SO4;Zn.
点评 本题考查氧化还原反应,为高考常见题型,把握反应中元素的化合价变化为解答的关键,侧重基本概念的考查,题目难度不大.

练习册系列答案
相关题目
3.表中能量表示将1mol分子完全拆解成原子所消耗的能量,
已知A2(g)与氢气化合生成1molHA(g)时放出的热量为92.5kJ,结合以上信息,下列说法正确的是( )
| 物质 | H2(g) | A2(g) | B2(g) | HA(g) | HB(g) |
| 能量(kJ) | 436 | a | 193 | 432 | 366 |
| A. | 能量最高的分子是H2 | B. | 最稳定的分子是B2 | ||
| C. | a=243 | D. | HB(g)+A2(g)═B2(g)+HA(g) 是吸热反应 |
4.向CuSO4溶液中逐滴加入KI溶液至过量,观察到产生白色沉淀CuI,溶液变为棕色.再向反应后的混合物中不断通人SO2气体,溶液逐渐变成无色.下列分析正确的是( )
| A. | 滴加KI溶液时,转移2 mol e-时生成 1 mol白色沉淀 | |
| B. | 通入SO2后溶液逐渐变成无色,体现了 SO2的漂白性 | |
| C. | 通入SO2时,SO2与I2反应,I2作还原剂 | |
| D. | 上述实验条件下,物质的氧化性:Cu2+>I2>SO2 |
8.设NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 标准状况下2.24L己烷分子中含1.9NA对共用电子 | |
| B. | 常温下4.4g的CO2和N2O混合物中,所含有的原子数为0.3 NA | |
| C. | 0.1mol Fe与0.1 mol Cl2反应时失电子数为0.3NA | |
| D. | 电解精炼铜时,阳极质量每减少32g 电路中就转移NA个电子 |
3.下列物质不能通过氯气与相应单质直接化合而成的是( )
| A. | NaCl | B. | FeCl2 | C. | HCl | D. | FeCl3 |
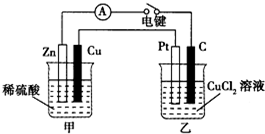 某兴趣小组的同学用如图所示装置研究有关电化学的问题.当闭合装置的电键时,观察到电流表的指针发生了偏转.请回答下列问题:
某兴趣小组的同学用如图所示装置研究有关电化学的问题.当闭合装置的电键时,观察到电流表的指针发生了偏转.请回答下列问题:
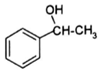 +CH2=CHCOOH$?_{△}^{浓H_{2}SO_{4}}$
+CH2=CHCOOH$?_{△}^{浓H_{2}SO_{4}}$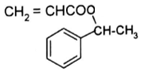 +H2O.
+H2O.