��Ŀ����
5��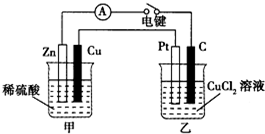 ij��ȤС���ͬѧ����ͼ��ʾװ���о��йص绯ѧ�����⣮���պ�װ�õĵ��ʱ���۲쵽��������ָ�뷢����ƫת����ش��������⣺
ij��ȤС���ͬѧ����ͼ��ʾװ���о��йص绯ѧ�����⣮���պ�װ�õĵ��ʱ���۲쵽��������ָ�뷢����ƫת����ش��������⣺��1����װ�õ�������ԭ��أ�PtΪ������A���� B����C���� D��������
��2��д���缫��Ӧʽ��Cu��2H++2e-=H2����C��Cu2++2e-=Cu��
��3�������е缫���䣬������Һ���ɱ���NaCl��Һ��������Һ���ܷ�Ӧ�����ӷ���ʽΪ2Cl-+2H2O$\frac{\underline{\;���\;}}{\;}$Cl2��+H2��+2OH-����Ҫʹ��Һ�ָ���ԭ������Һ��Ũ�ȣ���Ҫ������������Ȼ��⣨�����ƣ���
��4�������е缫���䣬������Һ���ɱ���CuSO4��Һ�������в���0.1mol����ʱ����·��ת�Ƶĵ�������1.204��1023����0.2NA����������ҺH+��Ũ����1mol/L��������Һ�����200mL���ҵ���������Һ������䣩��
���� ��1�����ݹ���ԭ��ص�����֪����װ��Ϊͭпԭ��أ�ZnΪ������CuΪ��������װ��Ϊ���أ�������������Ϊ������
��2��Cu���������ӵõ��ӣ�C����ͭ���ӵõ��ӣ�
��3�������е缫���䣬����Һ���ɱ����Ȼ�����Һ����Ϊ���NaCl��Һ�����������ƣ�Ҫ�ָ�ԭ��Һ��Ũ��������ʲô��ʲô��
��4������ԭ��ء������е����غ㣬�����в���0.1mol����ʱ��ת��0.2mol���ӣ����ݵ����غ��������ת�Ƶ�������������Ũ�ȣ�
��� �⣺��1����ͼ�е�ͭ��п���ֵ缫�͵����ϡ����ͱպϵ�·֪����װ��Ϊԭ��أ�Zn���ã���Zn��������Cu������������װ��Ϊ���أ�C���븺������Ϊ������Pt������������Ϊ������
�ʴ�Ϊ��ԭ��أ�����
��2����װ��Ϊԭ��أ�Cu��Ϊ�����������������ӵõ��ӣ������ϵķ�ӦΪ��2H++2e-=H2������װ��Ϊ���أ�C���븺������Ϊ������������ͭ���ӵõ��ӣ���缫��ӦΪCu2++2e-=Cu��
�ʴ�Ϊ��2H++2e-=H2����Cu2++2e-=Cu��
��3�������е缫���䣬����Һ���ɱ����Ȼ�����Һ����Ϊ���NaCl��Һ�����������ƣ������ܷ�ӦΪ2Cl-+2H2O$\frac{\underline{\;���\;}}{\;}$Cl2��+H2��+2OH-�����������Ӻ������ӣ���Ҫ�ָ�ԭ��Һ��Ũ������Ȼ��⣬
�ʴ�Ϊ��2Cl-+2H2O$\frac{\underline{\;���\;}}{\;}$Cl2��+H2��+2OH-���Ȼ��⣻
��4������ԭ��ء������е����غ㣬�����в���0.1mol����ʱ������2H++2e-=H2������ת��0.2mol���ӣ���������·��ת�Ƶ�����Ϊ1.204��1023����0.2NA�������е������ͭ�Ƿ������ᣬ�����缫��ӦʽΪ2H2O-4e-=O2��+4H+��ת��0.2mol���ӣ�������������0.2mol���������ӵ�Ũ��Ϊ0.2mol��0.2L=1mol/L��
�ʴ�Ϊ��1.204��1023����0.2NA����1mol/L��
���� ���⿼����ԭ��غ͵���ԭ������ȷ�ж�ԭ��غ͵����ǽⱾ��ؼ����������ӵķŵ�˳������·��ת�Ƶ����������������Ѷ��еȣ�

 ȫ�̽��ϵ�д�
ȫ�̽��ϵ�д�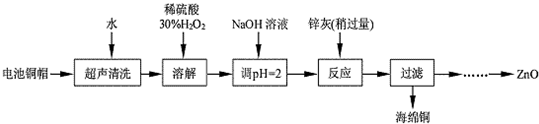
��1��д��ͭñ�ܽ�ʱͭ������ϡ���ᡢ30%H2O2��Ӧ�����ӷ�Ӧ����ʽ��Cu+H2O2+2H+=Cu2++2H2O��ͭñ�ܽ���ȫ������ȣ����У�����Һ�й�����H2O2��ȥ��
��2��Ϊȷ������п�ң���Ҫ�ɷ�ΪZn��ZnO������Ϊ�����������������ʵ������ⶨ��ȥH2O2 ����Һ��Cu2+�ĺ�����ʵ�����Ϊ��ȷ��ȡһ������ĺ���Cu2+����Һ�ڴ�����ƿ�У�������ˮϡ�ͣ�������ҺpH=3��4�����������KI����Na2S2O3����Һ�ζ����յ㣮���������з�Ӧ�����ӷ���ʽ���£�
2Cu2++4I-=2CuI����ɫ����+I2 2S2O32-+I2=2I-+S4O62-
�ٵζ�ѡ�õ�ָʾ��Ϊ������Һ���ζ��յ�۲쵽������Ϊ��ɫ��ȥ��
��ijͬѧ��ȡ1.0g���ͭñ����ʵ�飬�õ�100.00mL����Cu2+����Һ����ȡ20.00mL��������Cu2+����Һ�ڴ�����ƿ�У�������ˮϡ�ͣ�������ҺpH=3��4�����������KI����0.1000mol/L Na2S2O3����Һ�ζ����յ㣮���ظ�����ʵ��3�Σ���¼�������£�
| ʵ���� | 1 | 2 | 3 | 4 |
| V��Na2S2O3����mL�� | 28.32 | 25.31 | 25.30 | 25.32 |
��3�������£�����50mL 0.0001mol/L CuSO4��Һ�м���50mL0.00022mol/LNaOH��Һ�������˳�������֪KSP[Cu ��OH��2]=2.0��10-20��mol/L��3������������ɺ���Һ��c��Cu2+��=2��10-10 mol/L��
��4����֪pH��11 ʱZn��OH��2 ������NaOH��Һ����[Zn��OH��4]2-���±��г��˼������������������������pH����ʼ������pH ����������Ũ��Ϊ1.0mol•L-1���㣩��
| ��ʼ������pH | ������ȫ��pH | |
| Fe3+ | 1.1 | 3.2 |
| Fe2+ | 1.8 | 8.8 |
| Zn2+ | 5.9 | 8.9 |
�ڵμ�1.0mol•L-1NaOH��������ҺPHԼΪ5����3.2��pH��5.9����ʹFe3+������ȫ���۹��ˣ�
������Һ�еμ�1.0mol•L-1NaOH��������ҺPHԼΪ10����8.9��pH��11����ʹZn2+������ȫ���ݹ��ˡ�ϴ�ӡ������900�����գ�

��֪��298Kʱ�����ӿ�ʼ��������ȫ����ʱ��pH�����ʾ��
| ���� | ��ʼ����ʱ��pH | ��ȫ����ʱ��pH |
| Fe2+ | 6.34 | 9.7 |
| Fe3+ | 1.48 | 3.2 |
| Zn2+ | 6.2 | 8.0 |
��1������ͭп���к���������CuS��ZnS����H2SO4��������ZnS�����ܽ��CuS���ܣ�����������ͬ�¶��£�Ksp��CuS����Ksp��ZnS����ѡ�������������=������
��2������Ϊ�ڳ���������ѡ�����������е�C������ţ���Ϊ�Լ����DZȽϺ��ʵģ�
A��KMnO4 B��HNO3 C��H2O2 D��Cl2
��3�����������м��백ˮ��Ŀ���ǵ�����Һ��pH��pHӦ������3.2��6.2��Χ֮�䣮
��4����д���Ӽ����ʺ��백ˮ���Ƶ�����Һ��pH������Fe��OH��3��Ӧ�����ӷ���ʽFe3++3NH3•H2O�TFe�vOH��3��+3NH4+��
��5��298Kʱ������������Һ�е�c��Fe3+����2.7��10-15.6mol/L���£�[Fe��OH��3��Ksp=2.70��10-39]��
| A�� | �����������ܽ���AlCl3��Һ�У�2Na+2H2O=2Na++H2�� | |
| B�� | ���ܽ���NaOH��Һ�У�2Al+2OH-+2H2O=2AlO2-+3H2�� | |
| C�� | MgO���ڴ����У�MgO+2H+=H2O+Mg2+ | |
| D�� | Al��OH��3����ϡ�����У�OH-+H+=H2O |
| A�� | $\frac{1000A}{22.4}$ | B�� | $\frac{1000A��}{17A+22.4B}$mol/L | ||
| C�� | $\frac{A}{22.4}$mol/L | D�� | $\frac{1000��}{17A+22.4B}$mol/L |
| A�� | 5.6 g�����������ᷴӦ����H2�����Ϊ2.24 L | |
| B�� | 32 g������O3������ԭ����ĿΪ3NA | |
| C�� | ��״���£�11.2 L CCl4������ԭ����ĿΪ1.5NA | |
| D�� | ���³�ѹ�£�46g NO2��N2O4�������������ԭ����ĿΪ3NA |
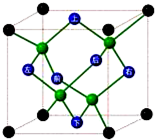 A��B��C��D��E��F����Ԫ�ص�ԭ���������ε�������֪��
A��B��C��D��E��F����Ԫ�ص�ԭ���������ε�������֪�� cm��������ܶ�Ϊ$\frac{��}{64}$g/cm3��
cm��������ܶ�Ϊ$\frac{��}{64}$g/cm3��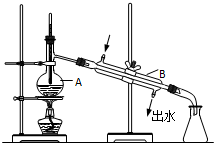 ��ͼΪʵ������ȡ����ˮ��װ��ʾ��ͼ������ͼʾ�ش��������⣮
��ͼΪʵ������ȡ����ˮ��װ��ʾ��ͼ������ͼʾ�ش��������⣮