题目内容
8.设NA为阿伏加德罗常数的值,下列叙述正确的是( )| A. | 标准状况下2.24L己烷分子中含1.9NA对共用电子 | |
| B. | 常温下4.4g的CO2和N2O混合物中,所含有的原子数为0.3 NA | |
| C. | 0.1mol Fe与0.1 mol Cl2反应时失电子数为0.3NA | |
| D. | 电解精炼铜时,阳极质量每减少32g 电路中就转移NA个电子 |
分析 A、标况下己烷为液态;
B、CO2和N2O的摩尔质量均为44g/mol,且均含3个原子;
C、0.1mol铁和0.1mol氯气反应,铁过量,根据氯气反应后变为-1价来分析;
D、电解精炼铜时,阳极上放电的不止是铜,还有比铜活泼的金属.
解答 解:A、标况下己烷为液态,故不能根据气体摩尔体积来计算其物质的量,故A错误;
B、CO2和N2O的摩尔质量均为44g/mol,故4.4g混合物的物质的量为0.1mol,且两者均含3个原子,故0.1mol混合物中含0.3NA个原子,故B正确;
C、0.1mol铁和0.1mol氯气反应,铁过量,而氯气反应后变为-1价,故0.1mol氯气得0.2mol电子,则铁失去0.2mol电子即0.2NA个,故C错误;
D、电解精炼铜时,阳极上放电的不止是铜,还有比铜活泼的金属,故当阳极质量减少32g时,失去的电子多于NA个,故D错误.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案
相关题目
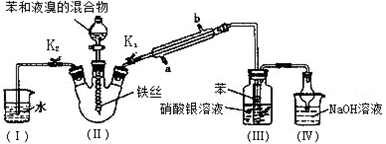
19.青蒿素,是烃的含氧衍生物,为无色针状晶体,易溶于丙酮、氯仿和苯中,在甲醇、乙醇、乙醚、石油醚中可溶解,在水中几乎不溶,熔点为156~157℃,热稳定性差,青蒿素是高效的抗疟药.已知:乙醚沸点为35℃.从青蒿中提取青蒿素的方法之一是以萃取原理为基础的,主要有乙醚浸取法和汽油浸取法.乙醚浸取法的主要工艺如图所示.
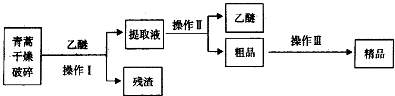
请回答下列问题:
(1)操作Ⅱ的名称是蒸馏.
(2)操作Ⅲ的主要过程可能是B(填字母).
A.加水溶解,蒸发浓缩、冷却结晶
B.加95%的乙醇,浓缩、结晶、过滤
C.加入乙醚进行萃取分液
(3)用如图所示实验装置测定青蒿素分子式的方法如下:将28.2g青蒿素样品放在硬质玻璃管C中,缓缓通入空气数分钟后,再充分燃烧,精确测定装置E和F实验前后的质量,根据所测数据计算.
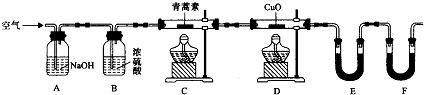
①装置E中盛放的物质是CaCl2或P2O5,装置F中盛放的物质是碱石灰.装置D的作用是使生成的CO转化成CO2而被吸收.
②该实验装置可能会产生误差,造成测定含氧量偏低,改进方法是在装置F后连接一个防止空气中的CO₂和水蒸气进入F的装置.
③用合理改进后的装置进行试验,称得:
则测得青蒿素的最简式是C15H22O5.
(4)充分燃烧后还需缓缓通入空气数分钟的目的是使生成的CO2和水蒸气全部赶到装置E和装置F中被完全吸收.

请回答下列问题:
(1)操作Ⅱ的名称是蒸馏.
(2)操作Ⅲ的主要过程可能是B(填字母).
A.加水溶解,蒸发浓缩、冷却结晶
B.加95%的乙醇,浓缩、结晶、过滤
C.加入乙醚进行萃取分液
(3)用如图所示实验装置测定青蒿素分子式的方法如下:将28.2g青蒿素样品放在硬质玻璃管C中,缓缓通入空气数分钟后,再充分燃烧,精确测定装置E和F实验前后的质量,根据所测数据计算.

①装置E中盛放的物质是CaCl2或P2O5,装置F中盛放的物质是碱石灰.装置D的作用是使生成的CO转化成CO2而被吸收.
②该实验装置可能会产生误差,造成测定含氧量偏低,改进方法是在装置F后连接一个防止空气中的CO₂和水蒸气进入F的装置.
③用合理改进后的装置进行试验,称得:
| 装置 | 实验前/g | 试验后/g |
| E | 22.6 | 42.4 |
| F | 80.2 | 146.2 |
(4)充分燃烧后还需缓缓通入空气数分钟的目的是使生成的CO2和水蒸气全部赶到装置E和装置F中被完全吸收.
16.某科研小组设计出利用工业废酸(10%H2SO4)来堆浸某废弃的氧化铜锌矿制取活性ZnO的方案,实现废物综合利用,方案如图所示.

已知:298K时各离子开始沉淀及完全沉淀时的pH如表所示.
请回答下列问题:
(1)氧化铜锌矿中含有少量的CuS和ZnS,在H2SO4的作用下ZnS可以溶解而CuS不溶,这是由于相同温度下:Ksp(CuS)<Ksp(ZnS)(选填“>”“<”或“=”).
(2)你认为在除铁过程中选用下列物质中的C(填序号)作为试剂甲是比较合适的.
A.KMnO4 B.HNO3 C.H2O2 D.Cl2
(3)除铁过程中加入氨水的目的是调节溶液的pH,pH应控制在3.2~6.2范围之间.
(4)请写出加甲物质后,加入氨水控制调节溶液的pH下生成Fe(OH)3反应的离子方程式Fe3++3NH3•H2O═Fe﹙OH)3↓+3NH4+.
(5)298K时,残留在乙溶液中的c(Fe3+)在2.7×10-15.6mol/L以下.[Fe(OH)3的Ksp=2.70×10-39].

已知:298K时各离子开始沉淀及完全沉淀时的pH如表所示.
| 离子 | 开始沉淀时的pH | 完全沉淀时的pH |
| Fe2+ | 6.34 | 9.7 |
| Fe3+ | 1.48 | 3.2 |
| Zn2+ | 6.2 | 8.0 |
(1)氧化铜锌矿中含有少量的CuS和ZnS,在H2SO4的作用下ZnS可以溶解而CuS不溶,这是由于相同温度下:Ksp(CuS)<Ksp(ZnS)(选填“>”“<”或“=”).
(2)你认为在除铁过程中选用下列物质中的C(填序号)作为试剂甲是比较合适的.
A.KMnO4 B.HNO3 C.H2O2 D.Cl2
(3)除铁过程中加入氨水的目的是调节溶液的pH,pH应控制在3.2~6.2范围之间.
(4)请写出加甲物质后,加入氨水控制调节溶液的pH下生成Fe(OH)3反应的离子方程式Fe3++3NH3•H2O═Fe﹙OH)3↓+3NH4+.
(5)298K时,残留在乙溶液中的c(Fe3+)在2.7×10-15.6mol/L以下.[Fe(OH)3的Ksp=2.70×10-39].
3.C、N、S元素都是生命体的重要组成元素,它们在自然界的平衡已受到较大的破坏.C、N、S元素在地球大气圈、岩石圈、水系、生物圈等的循环过程中会产生的物质是( )
①HNO3 ②CO2 ③糖类 ④CH4 ⑤SO2.
①HNO3 ②CO2 ③糖类 ④CH4 ⑤SO2.
| A. | ①②③④⑤ | B. | ②③⑤ | C. | ②③④ | D. | ② |
20.下列离子方程式正确的是( )
| A. | 少量金属钠溶解在AlCl3溶液中:2Na+2H2O=2Na++H2↑ | |
| B. | 铝溶解在NaOH溶液中:2Al+2OH-+2H2O=2AlO2-+3H2↑ | |
| C. | MgO溶于醋酸中:MgO+2H+=H2O+Mg2+ | |
| D. | Al(OH)3溶于稀硫酸中:OH-+H+=H2O |
17.在标准状况下,A L NH3溶于B mL水中,得到密度为ρg/cm3的R L氨水,则此氨水的物质的量浓度是( )
| A. | $\frac{1000A}{22.4}$ | B. | $\frac{1000Aρ}{17A+22.4B}$mol/L | ||
| C. | $\frac{A}{22.4}$mol/L | D. | $\frac{1000ρ}{17A+22.4B}$mol/L |
18.提纯含有少量固体杂质NaCl的KNO3,正确的实验操作是( )
| A. | 溶解,过滤 | B. | 溶解,蒸发浓缩,冷却结晶,过滤 | ||
| C. | 溶解,蒸发结晶 | D. | 溶解,萃取,分液 |