题目内容
16.将H2S、SO2、SO3各0.01mol,依次溶于1L水中,则最后得到的溶液有( )| A. | 中性、漂白性 | B. | 酸性、漂白性 | C. | 只有酸性 | D. | 只有漂白性 |
分析 在水溶液中发生的反应为SO3+H2O=H2SO4、2H2S+SO2=3S↓+2H2O,SO3极易和水反应生成硫酸,根据方程式知,H2S、SO2反应生成S和水,且SO2有一半剩余,部分SO2和水反应方程式为SO2+H2O=H2SO2,则溶液中溶质有H2SO4、H2SO2、SO2,据此分析解答.
解答 解:在水溶液中发生的反应为SO3+H2O=H2SO4、2H2S+SO2=3S↓+2H2O,SO3极易和水反应生成硫酸,根据方程式知,H2S、SO2反应生成S和水,且SO2有一半剩余,部分SO2和水反应方程式为SO2+H2O=H2SO2,则溶液中溶质有H2SO4、H2SO2、SO2,所以溶液具有酸性和漂白性,故选B.
点评 本题考查含硫物质性质,为高频考点,明确物质发生的反应及溶液中溶质成分是解本题关键,注意:硫化氢和二氧化硫反应生成S和水,题目难度不大.

练习册系列答案
 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案
相关题目
6.下列混合物的分离方法不正确的是( )
| A. | 沸点不同的液体可用蒸馏的方法分离 | |
| B. | 易溶与难溶的固体混合物可用溶解、过滤、蒸发、结晶的方法分离 | |
| C. | 用酒精可以从碘水中萃取碘 | |
| D. | 汽油和水的化合物不可以用分液漏斗分离 |
7.下列说法正确的是( )
| A. | 反应2Mg+CO2═2MgO+C△H<0从熵变角度看,可自发进行 | |
| B. | 在密闭容器发生可逆反应:2NO(g)+2CO(g)?N2(g)+2CO2(g)△H=-113.0kJ/mol,达到平衡后,保持温度不变,缩小容器体积,重新达到平衡后,△H变小 | |
| C. | 已知:Ksp(AgCl)=1.8×10-10,Ksp(Ag2CrO4)=2.0×10-12,将等体积的浓度为1.0×10-4mol/L的AgNO3溶液滴入到浓度为1.0×10-4mol/L的KCl和K2CrO4的混合溶液中产生两种不同沉淀,且Ag2CrO4沉淀先产生 | |
| D. | 根据HClO的Ka=3.0×10-8mol/L,H2CO3的Ka1=4.3×10-7mol/L,Ka2=5.6×10-11mol/L,可推测相同状况下,等浓度的NaClO与Na2CO3溶液中,pH前者小于后者 |
4.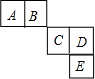 前四周期主族元素A、B、C、D、E在元素周期表中的相对位置如图所示,其中C元素原子的最外层电子数与最内层电子敦之和等于其电子总数的一半,下列说法正确的是( )
前四周期主族元素A、B、C、D、E在元素周期表中的相对位置如图所示,其中C元素原子的最外层电子数与最内层电子敦之和等于其电子总数的一半,下列说法正确的是( )
 前四周期主族元素A、B、C、D、E在元素周期表中的相对位置如图所示,其中C元素原子的最外层电子数与最内层电子敦之和等于其电子总数的一半,下列说法正确的是( )
前四周期主族元素A、B、C、D、E在元素周期表中的相对位置如图所示,其中C元素原子的最外层电子数与最内层电子敦之和等于其电子总数的一半,下列说法正确的是( )| A. | 元素A、B的所有氢化物中均只含有极性共价键 | |
| B. | 元素C、D形成的简单离子的电子总数不同 | |
| C. | 元素C、D、E形成的常见单质的熔沸点大小:E>D>C | |
| D. | C、D、E三种元素最高价氧化物对应的水化物中D的酸性最强 |
11.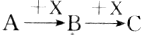 已知A、B、C三种物质有如图所示的转化关系(反应可在溶液中进行),其中A与C在一定条件下也能发生反应,则A不可能是( )
已知A、B、C三种物质有如图所示的转化关系(反应可在溶液中进行),其中A与C在一定条件下也能发生反应,则A不可能是( )
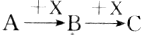 已知A、B、C三种物质有如图所示的转化关系(反应可在溶液中进行),其中A与C在一定条件下也能发生反应,则A不可能是( )
已知A、B、C三种物质有如图所示的转化关系(反应可在溶液中进行),其中A与C在一定条件下也能发生反应,则A不可能是( )| A. | SiO2 | B. | CH3CH2OH | C. | AlCl3 | D. | Cl2 |
1.以下关于化学反应速率的说法正确的是( )
| A. | 化学反应速率可用某时刻生成物的物质的量浓度的增加来表示 | |
| B. | 在同一反应中,用各种物质表示的化学反应速率的大小相等 | |
| C. | 化学反应速率是指单位时间内反应物浓度的减少或生成物浓度的增加 | |
| D. | 若反应现象在短时间内出现,则反应速率快,反应现象若不出现,则该反应速率一定慢 |
6.下列物质属于合金的是( )
| A. | 水银 | B. | 石墨 | C. | 硅晶体 | D. | 青铜 |
4.为了除去FeSO4溶液中的Fe2(SO4)3和CuSO4,最好选用的试剂是( )
| A. | 烧碱溶液 | B. | 浓氨水 | C. | 铁粉 | D. | 硫酸 |