题目内容
8.实验室可以用二氧化锰和浓盐酸反应制取氯气,方程式如下:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,如图是某学生设计的试验室制备干燥Cl2的实验装置图,根据图中的装置和有关试剂回答下列问题: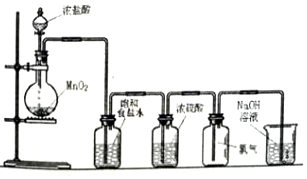
(1)该实验中还缺少一种仪器,这种仪器是酒精灯;
(2)饱和食盐水的作用是除去氯气中的氯化氢;
(3)氯气与冷的氢氧化钠溶液反应生成NaCl、NaClO和H2O,与热的氢氧化钠溶液按照下面的反应进行:3Cl2+6NaOH(热)-5NaCl+1NaClO3+3H2O,请配平上述反应方程式;
(4)8.7gMnO2和足量的浓盐酸反应,其中被氧化的HCl的物质的量为0.2mol.
分析 (1)二氧化锰与浓盐酸反应需要加热,据此判断缺少仪器;
(2)浓盐酸易挥发,制备的氯气中含有氯化氢、水蒸气,依次通过盛有饱和食盐水、浓硫酸的洗气瓶除去杂质;
(3)分析反应中元素化合价变化,依据氧化还原反应得失电子守恒、原子个数守恒配平方程式;
(4)依据方程式:MnO2+4HCl$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O可知消耗4mol氯化氢,被氧化的氯化氢物质的量为2mol,据此解答.
解答 解:(1)二氧化锰与浓盐酸反应需要加热,所以图中缺少仪器为酒精灯;
故答案为:酒精灯;
(2)浓盐酸易挥发,制备的氯气中含有氯化氢、水蒸气,氯化氢易溶于水,氯气在饱和食盐水中溶解度不大,所以可以选择饱和食盐水除去氯气中的氯化氢;
故答案为:除去氯气中的氯化氢;
(3)反应中氯气中0价的氯,部分化合价升高为氯酸钠中+5价,部分降为氯化钠中-1价,要使得失电子守恒则:氯化钠系数为5,氯酸钠系数为1,依据氯原子个数守恒氯气系数为3,依据钠原子个数守恒氢氧化钠稀释为6,依据氢原子个数守恒水系数为3,方程式:3Cl2+6NaOH(热)-5NaCl+1NaClO3+3H2O;
故答案为:3;6;5;1;3;
(4).7gMnO2物质的量为$\frac{8.7g}{87g/mol}$=0.1mol,与足量的浓盐酸反应消耗盐酸的物质为0.4mol,实际被氧化的氯化氢物质的量为0.2mol;
故答案为:0.2.
点评 本题考查了氯气的制备及性质检验,涉及氧化还原方程式的书写及氧化还原反应基本概念判断,为高频考点,把握氯气制备原理及反应中元素化合价变化为解答的关键,注意从元素化合价角度分析,侧重氧化还原反应基本概念和离子反应的考查,题目难度不大.

 阅读快车系列答案
阅读快车系列答案| A. | 1:3:6 | B. | 2:3:9 | C. | 9:3:1 | D. | 1:2:3 |
| A. |  | B. |  | C. |  | D. |  |
| A. | 燃煤中加入CaO后可减少酸雨的发生气体的排放 | |
| B. | 纤维素、蛋白质、油脂都是天然有机高分子化合物 | |
| C. | 纤维素在人体内可水解为葡萄糖,是人类重要的营养物质之一 | |
| D. | 明矾是一种水处理剂,可用于水的杀菌、消毒 |
| A. | 1,2,4-三甲苯  | B. | 3-甲基-1-戊烯 | C. | 2-甲基-1-丙醇  | D. | 1,3-二溴丙烷  |
| A. | Na与H2O的反应是熵增的放热反应,该反应能自发进行 | |
| B. | 常温下,NH4Cl溶液加水稀释,$\frac{c(N{H}_{3}•{H}_{2}O)•c({H}^{+})}{c(N{H}_{4}^{+})}$增大 | |
| C. | 0.1 mol•L-1NaCN溶液中含 HCN和CN-总数目为0.1×6.02×1023 | |
| D. | FeCl3和MnO2均可加快H2O2分解,同等条件下二者对H2O2分解速率的改变相同 |
| A. | NaHSO4溶液与Ba(OH)2溶液反应至中性:2H++SO42-+Ba2++2OH-═BaSO4↓+2H2O | |
| B. | 铁盐净水的原理:Fe3++3H2O?Fe(OH)3(胶体)+3H+ | |
| C. | 用少量氨水吸收工业尾气中的SO2:2NH3•H2O+SO2═2NH4++SO32-+H2O | |
| D. | Fe2O3溶于过量氢碘酸溶液中:Fe2O3+6H++2I-=2Fe2++I2+3H2O |
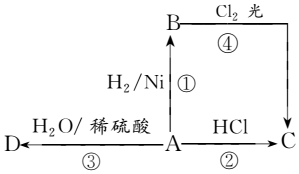 某烃A是有机化学工业的基本原料,其产量可以用来衡量一个国家的石油化工发展水平,A还是一种植物生长调节剂,A可发生如图所示的一系列化学反应,其中①②③属于同种反应类型.根据图回答下列问题:
某烃A是有机化学工业的基本原料,其产量可以用来衡量一个国家的石油化工发展水平,A还是一种植物生长调节剂,A可发生如图所示的一系列化学反应,其中①②③属于同种反应类型.根据图回答下列问题: