题目内容
13.次磷酸(H3PO2)是一种精细磷化工产品,具有较强还原性.回答下列问题:(1)H3PO2是一元中强酸,写出其电离方程式H3PO2?H2PO2-+H+.
(2)H3PO2及NaH2PO2均可将溶液中的Ag+还原为银,从而可用于化学镀银.
①H3PO2中,P元素的化合价为+1.
②利用H3PO2进行化学镀银反应中,氧化剂与还原剂的物质的量之比为4:1,则氧化产物为H3PO4(填化学式).
③NaH2PO2正盐(填“正盐”或“酸式盐”).
(3)H3PO2的工业制法是:将白磷(P4)与Ba(OH)2溶液反应生成PH3气体和Ba(H2PO2)2,后者再与H2SO4反应.写出白磷与Ba(OH)2溶液反应的化学方程式2P4+3Ba(OH)2+6H2O=3Ba(H2PO2)2+2PH3↑.
分析 (1)H3PO2是一元中强酸可知,H3PO2是弱电解质,溶液中部分电离出氢离子,据此写出电离方程式;
(2)①化合物中总化合价为0计算出P元素的化合价;
②先判断氧化剂、氧化剂,然后根据氧化剂与还原剂的物质的量之比为4:1计算出反应产物中P的化合价;
③H3PO2是一元中强酸,可以判断NaH2PO2为正盐;
(3)白磷(P4)与Ba(OH)2溶液反应生成PH3气体和Ba(H2PO2)2,结合电子守恒、原子守恒配平书写化学方程式.
解答 解:(1)H3PO2是一元中强酸,溶液中部分电离出氢离子,所以其电离方程式为:H3PO2?H2PO2-+H+,
故答案为:H3PO2?H2PO2-+H+;
(2)①H3PO2中,总化合价为0,其中氢元素为+1价,氧元素为-2价,则P元素的化合价为:+1价,
故答案为:+1;
②该反应中Ag+为氧化剂,H3PO2为还原剂,氧化剂与还原剂的物质的量之比为4:1,设反应产物中P的化合价为x,根据化合价升降相等可得,4×(1-0)=1×(x-1),解得x=5,所以氧化产物为+5价的H3PO4,
故答案为:H3PO4;
③由于H3PO2是一元中强酸,所以NaH2PO2为正盐,故答案为:正盐;
(3)白磷(P4)与Ba(OH)2溶液反应生成PH3气体和Ba(H2PO2)2,反应方程式为2P4+3Ba(OH)2+6H2O=3Ba(H2PO2)2+2PH3↑,
故答案为:2P4+3Ba(OH)2+6H2O=3Ba(H2PO2)2+2PH3↑.
点评 本题考查了盐的水解原理、弱电解质的电离、氧化还原反应等知识,题目难度中等,试题涉及的知识点较多,充分考查了学生对所学知识的掌握情况.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
2.短周期元素X、Y、Z、W的原子序数依次增大,其中,X和Z处于同一主族,而Y和W也处于同一主族.Z的单质可与冷水反应生成X的单质,WY2是一种常见的大气污染物.则下列有关说法不正确的是( )
| A. | 元素Y的单质与其他三种元素的单质都可发生反应 | |
| B. | 由上述四种元素组成的某种化合物的水溶液呈强酸性 | |
| C. | 在Y与Z形成的两种常见化合物中,阴阳离子个数比相同 | |
| D. | 常温下,铁、铝均可与W的最高价含氧酸的浓溶液发生剧烈反应 |
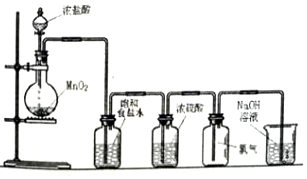
 锂-磷酸氧铜电池正极的活性物质是Cu4O(PO4)2,可通过下列反应制备:
锂-磷酸氧铜电池正极的活性物质是Cu4O(PO4)2,可通过下列反应制备: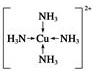 .
. 白磷与氧可发生如下反应:P4+5O2=P4O10.已知断裂下列化学键需要吸收的能量分别为:P-P akJ•mol-1、P-O bkJ•mol-1、P=O ckJ•mol-1、O=O dkJ•mol-1根据图示的分子结构和有关数据计算该反应的反应热(6a+5d-4c-12b)kJ•mol-1.
白磷与氧可发生如下反应:P4+5O2=P4O10.已知断裂下列化学键需要吸收的能量分别为:P-P akJ•mol-1、P-O bkJ•mol-1、P=O ckJ•mol-1、O=O dkJ•mol-1根据图示的分子结构和有关数据计算该反应的反应热(6a+5d-4c-12b)kJ•mol-1.