题目内容
19.某同学在预测CuCl2的性质时,依据CuCl2属于盐,预测出氯化铜溶液可能发生以下反应,请你填写下列表格.| 可能与某类物质反应 | 具体的离子反应方程式 | |
| CuCl2 | 金属单质 | ①Cu2++Fe=Cu+Fe2+ |
| ②氢氧化钠 | ③Cu2++2OH-=Cu(OH)2↓ | |
| ④硝酸银 | Ag++Cl-═AgCl↓ |
分析 氯化铜可电离出Cu2+、Cl-,可发生置换反应,Cu2+可与碱反应生成沉淀,Cl-可与银离子反应生成沉淀,以此解答该题.
解答 解:氯化铜可与金属单质发生酯化反应,如Cu2++Fe=Cu+Fe2+,可与氢氧化钠反应生成氢氧化铜沉淀,方程式为Cu2++2OH-=Cu(OH)2↓,可与硝酸银溶液反应生成氯化银沉淀,反应的离子方程式为Ag++Cl-═AgCl↓.
故答案为:
| 可能与某类物质反应 | 具体的离子反应方程式 | |
| CuCl2 | 金属单质 | ①Cu2++Fe=Cu+Fe2+ |
| ②氢氧化钠 | ③Cu2++2OH-=Cu(OH)2↓ | |
| ④硝酸银 | Ag++Cl-═AgCl↓ |
点评 本题综合考查铜及其化合物的性质,为高频考点,侧重考查学生的分析能力,注意从离子的角度判断氯化铜可能具有性质,难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
9.短周期元素X、Y、Z、W的原子序数依次增大,且原子最外层电子数之和为13.X的原子半径比Y的小,X与W同主族,Z是地壳中含量最高的元素.下列说法正确的是( )
| A. | 原子半径的大小顺序:r(Y)>r(Z)>r(W) | |
| B. | 元素Z、W的简单离子的电子层结构相同 | |
| C. | 元素Y 的简单气态氢化物的热稳定性比Z 的强 | |
| D. | 只含X、Y、Z三种元素的化合物,一定是共价化合物 |
10.某化学科研小组研究在其他条件不变时,改变某一条件对化学平衡的影响,得到如图所示变化规律(p表示压强,T表示温度,n表示物质的量):根据以上规律判断,下列结论正确的是( )


| A. | 反应Ⅰ:△H>0,p2>p1 | B. | 反应Ⅳ:△H<0,T2>T1 | ||
| C. | 反应Ⅲ:可能是△H>0,T2>T1 | D. | 反应Ⅱ:△H<0,T1<T2 |
7.10.0g某有机物在氧气中充分燃烧生成CO2和H2O,将这些燃烧产物与足量Na2O2充分反应,Na2O2能增重10.0g,此有机物不可能是( )
| A. | C6H12O6 | B. | C2H5OH | C. | HCHO | D. | CH3COOH |
4.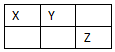 X、Y、Z、W是元素周期表前四周期元素,X、Y、Z是短周期元素,它们在周期表中的位置关系如图所示,其中Y原子的最外层电子数是电子层数的3倍.W的原子总数是Z的2倍.下列说法不正确的是( )
X、Y、Z、W是元素周期表前四周期元素,X、Y、Z是短周期元素,它们在周期表中的位置关系如图所示,其中Y原子的最外层电子数是电子层数的3倍.W的原子总数是Z的2倍.下列说法不正确的是( )
 X、Y、Z、W是元素周期表前四周期元素,X、Y、Z是短周期元素,它们在周期表中的位置关系如图所示,其中Y原子的最外层电子数是电子层数的3倍.W的原子总数是Z的2倍.下列说法不正确的是( )
X、Y、Z、W是元素周期表前四周期元素,X、Y、Z是短周期元素,它们在周期表中的位置关系如图所示,其中Y原子的最外层电子数是电子层数的3倍.W的原子总数是Z的2倍.下列说法不正确的是( )| A. | W位于元素周期表第四周期ⅥA族 | |
| B. | X、W、Z的最高正化合价依次升高 | |
| C. | X、Y、Z三种元素都能与氢形成18电子化合物 | |
| D. | 简单离子半径:W>Y>X>Z |
3.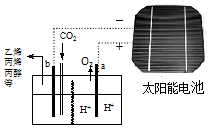 以二氧化碳为原料采用特殊的电极电解强酸性的二氧化碳水溶液可得到多种燃料,其原理如图所示. 下列说法不正确的是( )
以二氧化碳为原料采用特殊的电极电解强酸性的二氧化碳水溶液可得到多种燃料,其原理如图所示. 下列说法不正确的是( )
 以二氧化碳为原料采用特殊的电极电解强酸性的二氧化碳水溶液可得到多种燃料,其原理如图所示. 下列说法不正确的是( )
以二氧化碳为原料采用特殊的电极电解强酸性的二氧化碳水溶液可得到多种燃料,其原理如图所示. 下列说法不正确的是( )| A. | 该装置中能量转化形式至少有两种 | |
| B. | 点解完成后溶液的C(H+)略增大 | |
| C. | 如生成的氧气在标准状况下的体积为22.4L,则透向a极迁移的H+数目为4NA | |
| D. | 如生成乙烯,则b极的反应为:2CO2+12e-+12H+=C2H4+4H2O |
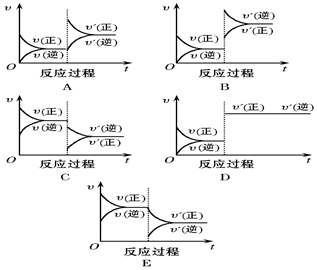 在一定条件下,反应A(g)+2B(s)?C(g)(正反应为吸热反应)达到平衡后,根据下列图象判断:
在一定条件下,反应A(g)+2B(s)?C(g)(正反应为吸热反应)达到平衡后,根据下列图象判断: