题目内容
7.10.0g某有机物在氧气中充分燃烧生成CO2和H2O,将这些燃烧产物与足量Na2O2充分反应,Na2O2能增重10.0g,此有机物不可能是( )| A. | C6H12O6 | B. | C2H5OH | C. | HCHO | D. | CH3COOH |
分析 有机物在O2中完全燃烧生成CO2和H2O,燃烧后全部产物通过足量Na2O2层,2CO2+2Na2O2=2Na2CO3+O2,质量增重△m=2Na2CO3-2Na2O2=2CO,可知反应后固体质量增加量为CO的质量;Na2O2与H2O反应2H2O+2Na2O2=4NaOH+O2,质量增重△m=2H2O-O2=2H2,可知反应后固体增加的质量为氢气质量,根据有机物的化学式和质量折合成CO和H2的质量,以此确定有机物分子式.
解答 解:有机物在O2中完全燃烧生成CO2和H2O,燃烧后全部产物通过足量Na2O2层,2CO2+2Na2O2=2Na2CO3+O2,质量增重△m=2Na2CO3-2Na2O2=2CO,可知反应后固体质量增加量为CO的质量;Na2O2与H2O反应2H2O+2Na2O2=4NaOH+O2,质量增重△m=2H2O-O2=2H2,可知反应后固体增加的质量为氢气质量,有机物可写成符合(CO)m•(H2)n,则
A.C6H12O6可写成(CO)6•(H2)6,故A正确;
B.C2H5OH可写成C•(CO)•(H2)3,故B错误;
C.HCHO可写成(CO)•(H2),故C正确;
D.CH3COOH可写成(CO)2•(H2)2,故D正确.
故选B.
点评 本题考查有机物的相关计算,为高频考点,侧重考查学生的分析、计算能力,题目难度中等,明确有机物燃烧产物与过氧化钠反应的质量增重关系为解答该题的关键,答题时注意体会.

练习册系列答案
相关题目
17.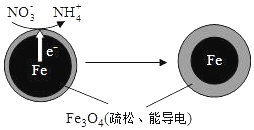 用零价铁(Fe)去除水体中的硝酸盐(NO3- )已成为环境修复研究的热点之一.
用零价铁(Fe)去除水体中的硝酸盐(NO3- )已成为环境修复研究的热点之一.
(1)Fe 还原水体中NO3- 的反应原理如图所示.
①作负极的物质是铁.
②正极的电极反应式是NO3-+8e-+10H+=NH4++3H2O.
(2)将足量铁粉投入水体中,经 24 小时测 定NO3- 的去除率和 pH,结果如下:
pH 由 2.5 变为 4.5 时,NO3- 的去除率低,是因为生成了较多的不导电的FeO(OH),写出生成FeO(OH)的离子方程式:Fe3++2H2O?FeO(OH)+3H+.
(3)实验发现:在初始 pH=4.5 的水体中投入足量铁粉的同时,补充一定量的 Fe2+可以明显提高NO3- 的去除率.是因为 Fe2+能够破坏FeO(OH),氧化层生成Fe2O3.写出该反应的离子方式Fe2++2FeO(OH)=Fe3O4+2H+.
 用零价铁(Fe)去除水体中的硝酸盐(NO3- )已成为环境修复研究的热点之一.
用零价铁(Fe)去除水体中的硝酸盐(NO3- )已成为环境修复研究的热点之一.(1)Fe 还原水体中NO3- 的反应原理如图所示.
①作负极的物质是铁.
②正极的电极反应式是NO3-+8e-+10H+=NH4++3H2O.
(2)将足量铁粉投入水体中,经 24 小时测 定NO3- 的去除率和 pH,结果如下:
| 初始pH | pH=2.5 | pH=4.5 |
| NO3-的去除率 | 接近100% | <50% |
| 24小时pH | 接近中性 | 接近中性 |
| 铁的最终物质形态 | 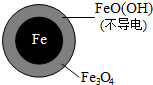 |  |
(3)实验发现:在初始 pH=4.5 的水体中投入足量铁粉的同时,补充一定量的 Fe2+可以明显提高NO3- 的去除率.是因为 Fe2+能够破坏FeO(OH),氧化层生成Fe2O3.写出该反应的离子方式Fe2++2FeO(OH)=Fe3O4+2H+.
18.下列化学用语正确的是( )
| A. | 乙烯结构式:CH2=CH2 | B. | 甲烷球棍模型: | ||
| C. | 乙炔比例模型: | D. | 羟基的电子式: |
15.下列叙述错误的是( )
| A. | 加入肥皂液产生浑浊的水是硬水 | |
| B. | 软水不一定是纯水 | |
| C. | 硬水中的钙、镁离子通过加热煮沸可以完全沉下 | |
| D. | 硬水加入石灰一纯碱后生成Mg(OH)2和CaCO3沉淀;利用离子交换剂也可把硬水软化 |
2.化学与生活、生产、环境、能源等关系密切,下列说法中正确的是( )
| A. | 大气中的SO2、NO2是酸性氧化物,与酸雨的形成密切相关 | |
| B. | 氢氧化铝常用于治疗胃酸过多,过量服用会造成重金属中毒 | |
| C. | 制豆腐时向豆浆中加入硫酸钙使蛋白质等聚沉,可制成豆腐 | |
| D. | 氢氧燃料电池是一种高能电池,释放的电能与等量氢气完全燃烧释放的热能相同 |
19.某同学在预测CuCl2的性质时,依据CuCl2属于盐,预测出氯化铜溶液可能发生以下反应,请你填写下列表格.
| 可能与某类物质反应 | 具体的离子反应方程式 | |
| CuCl2 | 金属单质 | ①Cu2++Fe=Cu+Fe2+ |
| ②氢氧化钠 | ③Cu2++2OH-=Cu(OH)2↓ | |
| ④硝酸银 | Ag++Cl-═AgCl↓ |
16.NA代表阿伏加德罗常数,下列说法正确的是( )
| A. | 常温常压下,2.24LC2H4和C2H2的混合气体中含碳原子数目小于0.2NA | |
| B. | 100mL1.0mol/L的FeCl3溶液与足量Cu反应,转移电子数数为0.2NA | |
| C. | 标况下44.8mL氯气通入足量水中发生反应,转移电子数为2×10-3NA | |
| D. | 常温下,pH=2的H2SO4溶液中含有的H+数目为0.02NA |
11.某白色粉末由两种物质组成,为鉴别其成分进行如下实验:
①取少量样品,加入足量水,仍有部分固体未溶解:过滤后,向所得固体中加入足量氢氧化钠溶液,固体全部溶解;
②另取少量样品加入足量氢氧化钠溶液,振荡后仍有固体存在.
该白色粉末可能为( )
①取少量样品,加入足量水,仍有部分固体未溶解:过滤后,向所得固体中加入足量氢氧化钠溶液,固体全部溶解;
②另取少量样品加入足量氢氧化钠溶液,振荡后仍有固体存在.
该白色粉末可能为( )
| A. | Ca(HCO3)2、Al(OH)3 | B. | Al(OH)3、NaHCO3 | C. | Na2SO3、Mg(OH)2 | D. | Na2CO3、CuSO4 |
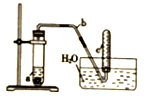 用图示简易装置可以进行某些氮氧化物气体的制取、收集及性质检验.
用图示简易装置可以进行某些氮氧化物气体的制取、收集及性质检验.