题目内容
4.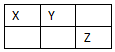 X、Y、Z、W是元素周期表前四周期元素,X、Y、Z是短周期元素,它们在周期表中的位置关系如图所示,其中Y原子的最外层电子数是电子层数的3倍.W的原子总数是Z的2倍.下列说法不正确的是( )
X、Y、Z、W是元素周期表前四周期元素,X、Y、Z是短周期元素,它们在周期表中的位置关系如图所示,其中Y原子的最外层电子数是电子层数的3倍.W的原子总数是Z的2倍.下列说法不正确的是( )| A. | W位于元素周期表第四周期ⅥA族 | |
| B. | X、W、Z的最高正化合价依次升高 | |
| C. | X、Y、Z三种元素都能与氢形成18电子化合物 | |
| D. | 简单离子半径:W>Y>X>Z |
分析 Y原子的最外层电子数是电子层数的3倍,应为O元素,则X为N元素,Z为Cl元素,W的原子总数是Z的2倍,原子序数为34,为Se元素,以此解答该题.
解答 解:A.W为Se,位于周期表第四周期ⅥA族,故A正确;
B.X为N元素,最高正价为+5价,W为Se,最高正价为+6价,Z为Cl,最高正价为+7价,故B正确;
C.可分别与氢气生成N2H4、H2O2、HCl,都为18电子,故C正确;
D.核外电子层数越多,离子半径越大,核外电子排布相同的离子,核电荷数越大离子半径越小,离子半径W>Z>X>Y,故D错误.
故选D.
点评 本题考查结构性质位置关系应用,为高考常见题型,侧重考查学生的分析能力,推断元素是解题关键,注意对元素周期律的理解掌握,难度不大.

练习册系列答案
相关题目
14.下列化学用语表述一定正确的是( )
| A. | 甲醛的电子式: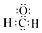 | |
| B. | 苯酚钠溶液中中通入少量二氧化碳气体: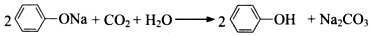 | |
| C. | 溴乙烷与氢氧化钠水溶液共热:C2H5Br+OH-$→_{△}^{H_{2}O}$CH2=CH2↑+Br-+H2O | |
| D. | 乙醇与灼热的氧化铜反应:CH3CH2OH+CuO$\stackrel{△}{→}$CH3CHO+Cu+H2O |
15.下列叙述错误的是( )
| A. | 加入肥皂液产生浑浊的水是硬水 | |
| B. | 软水不一定是纯水 | |
| C. | 硬水中的钙、镁离子通过加热煮沸可以完全沉下 | |
| D. | 硬水加入石灰一纯碱后生成Mg(OH)2和CaCO3沉淀;利用离子交换剂也可把硬水软化 |
19.某同学在预测CuCl2的性质时,依据CuCl2属于盐,预测出氯化铜溶液可能发生以下反应,请你填写下列表格.
| 可能与某类物质反应 | 具体的离子反应方程式 | |
| CuCl2 | 金属单质 | ①Cu2++Fe=Cu+Fe2+ |
| ②氢氧化钠 | ③Cu2++2OH-=Cu(OH)2↓ | |
| ④硝酸银 | Ag++Cl-═AgCl↓ |
9.下列说法正确的是( )
| A. | △H<0、△S>0的反应在温度低时不能自发进行 | |
| B. | NH4HCO3(s)═NH3(g)+H2O(g)+CO2(g)△H=+185.57kJ/mol能自发进行,原因是体系有自发地向混乱度增大的方向转变的倾向 | |
| C. | 因为焓变和熵变都与反应的自发性有关,因此焓变或熵变均可以单独作为反应自发性的判据 | |
| D. | 化学反应的限度不可以通过改变条件而改变 |
16.NA代表阿伏加德罗常数,下列说法正确的是( )
| A. | 常温常压下,2.24LC2H4和C2H2的混合气体中含碳原子数目小于0.2NA | |
| B. | 100mL1.0mol/L的FeCl3溶液与足量Cu反应,转移电子数数为0.2NA | |
| C. | 标况下44.8mL氯气通入足量水中发生反应,转移电子数为2×10-3NA | |
| D. | 常温下,pH=2的H2SO4溶液中含有的H+数目为0.02NA |
7.普及化学知识有助于人们树立健康的观念.下列观念正确的是( )
| A. | 天然物质都是绿色无毒的物质 | B. | 只饮用纯净水有益人体健康 | ||
| C. | 禁止吸烟可减少室内空气污染 | D. | 微量元素只能通过保健品摄入 |
8. 在200mL含Mg2+、Al3+、NH4-、H+、Cl-等离子的溶液中,逐滴加入4mol/LNaOH溶液,所加NaOH溶液的体积(mL)与产生沉淀的物质的量(mol)关系如图所示.下列叙述正确的是( )
在200mL含Mg2+、Al3+、NH4-、H+、Cl-等离子的溶液中,逐滴加入4mol/LNaOH溶液,所加NaOH溶液的体积(mL)与产生沉淀的物质的量(mol)关系如图所示.下列叙述正确的是( )
 在200mL含Mg2+、Al3+、NH4-、H+、Cl-等离子的溶液中,逐滴加入4mol/LNaOH溶液,所加NaOH溶液的体积(mL)与产生沉淀的物质的量(mol)关系如图所示.下列叙述正确的是( )
在200mL含Mg2+、Al3+、NH4-、H+、Cl-等离子的溶液中,逐滴加入4mol/LNaOH溶液,所加NaOH溶液的体积(mL)与产生沉淀的物质的量(mol)关系如图所示.下列叙述正确的是( )| A. | .原溶液的c(H+)=0.08mol/L | B. | 原溶液中n(Mg2+):n(Al3+)=10:1 | ||
| C. | x与y的差值为0.01mol | D. | 原溶液中c(Cl-)=0.066mol/L |
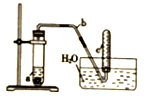 用图示简易装置可以进行某些氮氧化物气体的制取、收集及性质检验.
用图示简易装置可以进行某些氮氧化物气体的制取、收集及性质检验.