题目内容
3.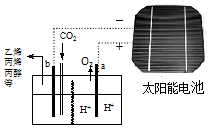 以二氧化碳为原料采用特殊的电极电解强酸性的二氧化碳水溶液可得到多种燃料,其原理如图所示. 下列说法不正确的是( )
以二氧化碳为原料采用特殊的电极电解强酸性的二氧化碳水溶液可得到多种燃料,其原理如图所示. 下列说法不正确的是( )| A. | 该装置中能量转化形式至少有两种 | |
| B. | 点解完成后溶液的C(H+)略增大 | |
| C. | 如生成的氧气在标准状况下的体积为22.4L,则透向a极迁移的H+数目为4NA | |
| D. | 如生成乙烯,则b极的反应为:2CO2+12e-+12H+=C2H4+4H2O |
分析 太阳能电池中光能转化为电能,电解强酸性的二氧化碳水溶液得到乙烯,电能转化为化学能;电解时,二氧化碳在b极上得电子发生还原反应生成乙烯,据此回答.
解答 解:A、太阳能电池中光能转化为电能还有一部分转化为热能,故A正确;
B、电解过程中,在阴极上是氢离子得电子的过程,氢离子浓度减小,所以溶液的C(H+)减小,故B错误;
C、如生成的氧气在标准状况下的体积为22.4L即1mol,则转移电子是4mol,则透向a极迁移的H+数目为4NA,故C正确;
D、电解时,二氧化碳在b极上得电子发生还原反应生成乙烯,电极反应式为2CO2+12H++12e-=C2H4+4H2O,故D正确;
故选B.
点评 本题考查原电池原理有关知识,为高频考点,注意电极反应式的书写是关键,题目难度不大.

练习册系列答案
 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案
相关题目
19.某同学在预测CuCl2的性质时,依据CuCl2属于盐,预测出氯化铜溶液可能发生以下反应,请你填写下列表格.
| 可能与某类物质反应 | 具体的离子反应方程式 | |
| CuCl2 | 金属单质 | ①Cu2++Fe=Cu+Fe2+ |
| ②氢氧化钠 | ③Cu2++2OH-=Cu(OH)2↓ | |
| ④硝酸银 | Ag++Cl-═AgCl↓ |
14.在0.1mol/L的NH3•H2O溶液中,关系正确的是( )
| A. | c (NH3•H2O)>c (NH4+)>c (H+)>c (OH-) | B. | c (NH4+)>c (NH3•H2O)>c (OH-)>c (H+) | ||
| C. | c (NH3•H2O)>c (NH4+)=c (OH-)>c (H+) | D. | c (NH3•H2O)>c (OH-)>c (NH4+)>c (H+) |
11.某白色粉末由两种物质组成,为鉴别其成分进行如下实验:
①取少量样品,加入足量水,仍有部分固体未溶解:过滤后,向所得固体中加入足量氢氧化钠溶液,固体全部溶解;
②另取少量样品加入足量氢氧化钠溶液,振荡后仍有固体存在.
该白色粉末可能为( )
①取少量样品,加入足量水,仍有部分固体未溶解:过滤后,向所得固体中加入足量氢氧化钠溶液,固体全部溶解;
②另取少量样品加入足量氢氧化钠溶液,振荡后仍有固体存在.
该白色粉末可能为( )
| A. | Ca(HCO3)2、Al(OH)3 | B. | Al(OH)3、NaHCO3 | C. | Na2SO3、Mg(OH)2 | D. | Na2CO3、CuSO4 |
18.实验室里需用480mL0.1mol•L-1的硫酸铜溶液,以下操作正确的是( )
| A. | 称取7.68g硫酸铜,加入 480mL水 | B. | 称取12.0g胆矾配成500mL溶液 | ||
| C. | 称取8.0g硫酸铜,加入500mL水 | D. | 称取12.5g胆矾配成500mL溶液 |
8. 在200mL含Mg2+、Al3+、NH4-、H+、Cl-等离子的溶液中,逐滴加入4mol/LNaOH溶液,所加NaOH溶液的体积(mL)与产生沉淀的物质的量(mol)关系如图所示.下列叙述正确的是( )
在200mL含Mg2+、Al3+、NH4-、H+、Cl-等离子的溶液中,逐滴加入4mol/LNaOH溶液,所加NaOH溶液的体积(mL)与产生沉淀的物质的量(mol)关系如图所示.下列叙述正确的是( )
 在200mL含Mg2+、Al3+、NH4-、H+、Cl-等离子的溶液中,逐滴加入4mol/LNaOH溶液,所加NaOH溶液的体积(mL)与产生沉淀的物质的量(mol)关系如图所示.下列叙述正确的是( )
在200mL含Mg2+、Al3+、NH4-、H+、Cl-等离子的溶液中,逐滴加入4mol/LNaOH溶液,所加NaOH溶液的体积(mL)与产生沉淀的物质的量(mol)关系如图所示.下列叙述正确的是( )| A. | .原溶液的c(H+)=0.08mol/L | B. | 原溶液中n(Mg2+):n(Al3+)=10:1 | ||
| C. | x与y的差值为0.01mol | D. | 原溶液中c(Cl-)=0.066mol/L |
12.2016年诺贝尔化学奖授予借助某些金属离子制造出复杂新分子,从而合成分子机器的三位科学家,合成新分子过程模拟如下:

下列有关信息错误的是( )

下列有关信息错误的是( )
| A. | 图中新月形分子和环状分子“组合”在一起,铜离子起关键作用 | |
| B. | 利用此方式可以合成新分子,同时也可能创造一种全新“机械键” | |
| C. | 在创造新分子技术中,铜离子是唯一可以借助的金属离子 | |
| D. | 此技术可以“互锁”合成 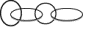 分子,甚至成更复杂的分子 分子,甚至成更复杂的分子 |