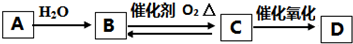题目内容
2.下列事实不能用勒夏特列(平衡移动)原理解释的是( )
| A. | 开启啤酒瓶后,瓶中马上泛起大量泡沫 | |
| B. | 将收集NO2气体的烧瓶密闭后,放在装有热水的烧杯中,发生颜色变化 | |
| C. | 合成氨时采用铁触媒作反应催化剂 | |
| D. | 工业上生产硫酸的过程中使用过量的空气以提高二氧化硫的利用率 |
分析 平衡移动原理是如果改变影响平衡的一个条件(如浓度、压强或温度等),平衡就向能够减弱这种改变的方向移动,平衡移动原理适用的对象应存在可逆过程,如与可逆过程无关,则不能用平衡移动原理解释,平衡移动原理对所有的动态平衡都适用.
解答 解:A、开启啤酒瓶后,瓶中马上泛起大量泡沫,是压强对其影响导致的,属于可逆过程,所以可以用平衡移动原理解释,故A不选;
B、二氧化氮和四氧化二氮之间存在2NO2?N2O4,放入热水中,向棕红色NO2生成的方向移动,可以用平衡移动原理解释,故B不选;
C、合成氨时采用铁触媒作反应催化剂是为了加快反应速率,但是加催化剂不会引起平衡的移动,不能用勒夏特列(平衡移动)原理解释,故C选;
D、工业上生产硫酸存在平衡2SO2+O2?2SO3,使用过量的空气,增大氧气的浓度,平衡向正反应移动,可以提高二氧化硫的利用率,能用勒夏特列原理解释,故D不选.
故选C.
点评 本题考查了勒夏特列原理的使用条件,难度不大,注意使用勒夏特列原理的前提必须是可逆反应.

练习册系列答案
 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案
相关题目
12.表为元素周期表的一部分,X、Y、Z、R为短周期元素,其中Y元素的原子最外层电子数是其内层电子数的3倍.
下列说法正确的是( )
| X | Y | |
| Z | R | |
| W |
| A. | 原子半径大小关系为:R>Y>X | |
| B. | X有多种同素异形体,而Y不存在同素异形体 | |
| C. | 根据元素周期律,可以推测W元素的单质具有半导体特性,W2Y3具有氧化性和还原性 | |
| D. | ZY2晶体熔化、液态RY3气化均需克服分子间作用力 |
13.下列说法错误的是( )
| A. | 化学键的断裂和形成是化学反应中能量变化的主要原因 | |
| B. | 煤炭燃烧前经过脱硫处理可减少酸雨的产生 | |
| C. | 燃料电池是一种高效、友好的发电装置,可将化学能完全转化为电能 | |
| D. | 太阳能的利用,一般是将太阳辐射能先转化为热能、电能或化学能,再加以利用 |
10.X、Y、Z、W是元素周期表前四周期中常见的元素,原子序数依次增大.其相关信息如下表:
(1)X的电负性比Y的小(填“大”或“小”);X 和Y的气态氢化物中,较稳定的是H2O(写化学式).
(2)W在周期表中的位置是第四周期第Ⅷ族,其基态原子价电子的电子排布式为3d64s2.
(3)Z2Y2的电子式为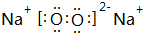 ,请写出Z2Y2与XY2反应的化学方程式2Na2O2+2CO2=2Na2CO3+O2.
,请写出Z2Y2与XY2反应的化学方程式2Na2O2+2CO2=2Na2CO3+O2.
(4)在XY2分子中X原子的杂化方式为sp,其分子的空间构型为直线形.氢、X、Y三种元素可共同形成多种分子和一种常见无机阴离子,写出其中一种分子与该无机阴离子反应的离子方程式:HCO3-+CH3COOH=CH3COO-+CO2↑+H2O.
| 元素 | 相关信息 |
| X | X的基态原子价层电子中有两个未成对电子 |
| Y | Y的基态原子最外层电子排布式为:nsnnpn+2 |
| Z | Z存在质量数为23,中子数为12的核素 |
| W | W有多种化合价,其白色氢氧化物在空气中会迅速变成灰绿色,最后变成红褐色 |
(2)W在周期表中的位置是第四周期第Ⅷ族,其基态原子价电子的电子排布式为3d64s2.
(3)Z2Y2的电子式为
 ,请写出Z2Y2与XY2反应的化学方程式2Na2O2+2CO2=2Na2CO3+O2.
,请写出Z2Y2与XY2反应的化学方程式2Na2O2+2CO2=2Na2CO3+O2.(4)在XY2分子中X原子的杂化方式为sp,其分子的空间构型为直线形.氢、X、Y三种元素可共同形成多种分子和一种常见无机阴离子,写出其中一种分子与该无机阴离子反应的离子方程式:HCO3-+CH3COOH=CH3COO-+CO2↑+H2O.
17.已知:(1)2H2(g)+O2(g)═2H2O(g);△H=a kJ•mol-1
(2)H2(g)+$\frac{1}{2}$O2(g)═H2O(g);△H=b kJ•mol-1
(3)2H2(g)+O2(g)═2H2O(l);△H=c kJ•mol-1
(4)H2(g)+$\frac{1}{2}$O2(g)═H2O(l);△H=d kJ•mol-1
下列关系式中,正确的是( )
(2)H2(g)+$\frac{1}{2}$O2(g)═H2O(g);△H=b kJ•mol-1
(3)2H2(g)+O2(g)═2H2O(l);△H=c kJ•mol-1
(4)H2(g)+$\frac{1}{2}$O2(g)═H2O(l);△H=d kJ•mol-1
下列关系式中,正确的是( )
| A. | a=2b<0 | B. | a=2c<0 | C. | c=2d>0 | D. | c>a>b |
7. 下表是某兴趣小组通过实验获得的相同体积足量稀硫酸与铁反应的实验数据:
下表是某兴趣小组通过实验获得的相同体积足量稀硫酸与铁反应的实验数据:
分析上述数据,回答下列问题:
(1)反应的离子方程式:Fe+2H+═Fe2++H2↑;
(2)①实验1、2可得出的结论是,硫酸浓度越稀,反应速率越慢;
②实验2、3可得出的结论是反应物接触面越大,反应速率越快;
③实验3、4可得出的结论是温度越高,反应速率越快.
(3)①用铁粉和稀硫酸反应制取H2,实验过程中绘制出生成H2的体积(V)与时间(t)的关系如图所示. 试分析判断OE段、EF段、FG段、GH段反应速率(分别用v (OE)、v (EF)、v (FG)、v (GH)表示)最快时段是B.
A.v (OE) B.v (EF)
C.v (FG) D.v (GH)
②1min内反应较慢的原因是:温度较低;一段时间后反应明显加快的原因是反应放热,使溶液的温度升高.
 下表是某兴趣小组通过实验获得的相同体积足量稀硫酸与铁反应的实验数据:
下表是某兴趣小组通过实验获得的相同体积足量稀硫酸与铁反应的实验数据:| 实验 序号 | 金属 质量/g | 金属 状态 | c(H2SO4) mol/L | 实验 温度/℃ | 金属消失 的时间/s | |
| 1 | 0.10 | 丝 | 0.7 | 20 | 250 | |
| 2 | 0.10 | 丝 | 1.0 | 20 | 200 | |
| 3 | 0.10 | 粉末 | 1.0 | 20 | 125 | |
| 4 | 0.10 | 粉末 | 1.0 | 30 | 50 |
(1)反应的离子方程式:Fe+2H+═Fe2++H2↑;
(2)①实验1、2可得出的结论是,硫酸浓度越稀,反应速率越慢;
②实验2、3可得出的结论是反应物接触面越大,反应速率越快;
③实验3、4可得出的结论是温度越高,反应速率越快.
(3)①用铁粉和稀硫酸反应制取H2,实验过程中绘制出生成H2的体积(V)与时间(t)的关系如图所示. 试分析判断OE段、EF段、FG段、GH段反应速率(分别用v (OE)、v (EF)、v (FG)、v (GH)表示)最快时段是B.
A.v (OE) B.v (EF)
C.v (FG) D.v (GH)
②1min内反应较慢的原因是:温度较低;一段时间后反应明显加快的原因是反应放热,使溶液的温度升高.
14.把m mol乙烯跟n mol H2混合于一密闭容器中,在适当条件下反应并生成p molC2H6,若将所得混合气体燃烧,并全部生成CO2和H2O,需要氧气的物质的量为( )
| A. | 3m+n | B. | 3m+$\frac{n}{2}$ | C. | 3m+3p+$\frac{n}{2}$ | D. | 3m+$\frac{n}{2}$-3p |