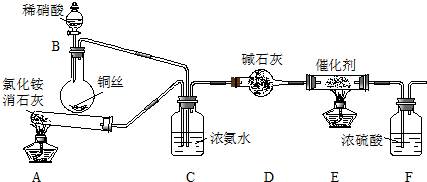
题目内容
12. 草酸亚铁晶体(FeC2O4•2H2O)呈淡黄色.某课题组为探究草酸亚铁晶体的化学性质,进行了一系列实验探究.
草酸亚铁晶体(FeC2O4•2H2O)呈淡黄色.某课题组为探究草酸亚铁晶体的化学性质,进行了一系列实验探究.(1)向盛有草酸亚铁晶体的试管中滴入几滴硫酸酸化的KMnO4溶液,振荡,发现溶液颜色逐渐变为棕黄色,并检测到二氧化碳气体生成.这说明草酸亚铁晶体具有还原性(填“氧化性”、“还原性”或“碱性”).若反应中消耗1mol FeC2O4•2H2O,则参加反应的KMnO4为0.6mol.
(2)资料表明:在密闭容器中加热到一定温度时,草酸亚铁晶体可完全分解,生成几种氧化物,残留物为黑色固体.课题组根据课本上所介绍的铁的氧化物的性质,对黑色固体的组成提出如下假设,请你完成假设二和假设三:
假设一:全部是FeO
假设二:全部是四氧化三铁
假设三:
(3)为验证上述假设一是否成立,课题组进行如下研究.
【定性研究】请你完成表中内容.
| 实验步骤(不要求写出具体操作过程) | 预期实验现象和结论 |
| 取少量黑色固体,加入适量稀盐酸或稀硫酸,在溶液中加入硫氰化钾溶液 | 溶液不变红色,则假设一成立,溶液变成红色,则假设一不成立 |
分析 (1)向盛有草酸亚铁晶体的试管中滴入几滴硫酸酸化的KMnO4溶液,振荡,发现溶液颜色逐渐变为棕黄色,并检测到CO2生成.说明草酸亚铁被氧化为铁离子、二氧化碳气体,草酸亚铁具有还原性,依据电子守恒计算得到消耗的高锰酸钾物质的量;
(2)草酸亚铁晶体可完全分解,生成几种氧化物,残留物为黑色固体可能为氧化亚铁或四氧化三铁,分析判断;
(3)【定性研究】氧化亚铁溶解于盐酸生成氯化亚铁溶液,加入KSCN溶液,若溶液不变红证明假设一正确;
【定量研究】根据图中提供的信息,通过计算可以判断反应的化学方程式和物质的化学式.
解答 解:(1)向盛有草酸亚铁晶体的试管中滴入几滴硫酸酸化的KMnO4溶液,振荡,发现溶液颜色逐渐变为棕黄色,并检测到CO2生成.说明草酸亚铁被氧化为铁离子、二氧化碳气体,草酸亚铁具有还原性,依据电子守恒计算得到消耗的高锰酸钾物质的量,依据氧化还原反应电子守恒原子守恒配平书写离子方程式为5Fe2++5C2O42-+3MnO4-+24H+=5Fe3++3Mn2++5CO2↑+12H2O,消耗1mol FeC2O4•2H2O,则参加反应的KMnO4为0.6mol,
故答案为:还原性;0.6;
(2)假设一:全部是氧化亚铁;假设二:全部是四氧化三铁;假设三:氧化亚铁和四氧化三铁的混合物,
故答案为:全部是四氧化三铁;氧化亚铁和四氧化三铁的混合物;
(3)【定性研究】实验步聚:取少量黑色固体,加入适量的稀盐酸(或稀硫酸)溶解,在溶液中加入KSCN溶液,现象与结论:若溶液不变红,则假设一成立,若溶液变红,则假设一不成立;
故答案为:
| 实验步骤(不要求写出具体操作程) | 预期实验现象和结论 |
| 加入适量稀盐酸或稀硫酸,在溶液中加入硫氰化钾溶液 | 溶液不变红色,则假设一成立,溶液变成红色,则假设一不成立 |
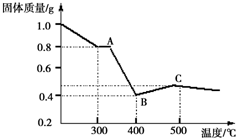
【定量研究】通过剩余固体的质量可知,过程Ⅰ发生的反应是:草酸亚铁晶体受热失去结晶水,设失去结晶水x,图象分析可知固体质量变化1.0-0.8=0.2g,依据则反应的化学方程式计算为:
FeC2O4•2H2O$\frac{\underline{\;\;△\;\;}}{\;}$FeC2O4•(2-x)H2O+xH2O△m
180 18x
1.0 0.2
x=2
加热到300°C,晶体全部失去结晶水生成草酸亚铁和水,
继续加热到400°C,固体质量减少0.8g-0.4g=0.4g;此时草酸亚铁分解减少的是气体质量,反应过程中一定存在反应生成氧化亚铁和二氧化碳,铁元素化合价不变时,依据元素化合价变化和电子守恒可知碳元素化合价从+3价变化为+4价,一定有化合价降低生成+2价的一氧化碳,反应的化学方程式FeC2O4$\frac{\underline{\;\;△\;\;}}{\;}$FeO+CO+CO2,
FeC2O4$\frac{\underline{\;\;△\;\;}}{\;}$FeO+CO+CO2 △m
144 72
0.8 0.4
计算结果符合图象固体质量变化,所以反应的化学方程式为FeC2O4•2H2O$\frac{\underline{\;\;△\;\;}}{\;}$FeO+CO↑+CO2↑+2H2O,
故答案为:FeC2O4•2H2O$\frac{\underline{\;\;△\;\;}}{\;}$FeO+CO↑+CO2↑+2H2O.
点评 本题考查了铁及其化合物性质的实验验证和实验分析判断,定量计算,图象分析是解题关键,题目难度较大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
1.生活中有很多化学问题.下列判断正确的是( )
| A. | 可乐饮料中含有的兴奋性物质咖啡因(C8H10O2N4)属于有机物 | |
| B. | 医疗上,碳酸氢钠是治疗胃穿孔的一种药剂 | |
| C. | 煤经气化和液化两个物理变化过程,可变为清洁能源 | |
| D. | 日常食用的冰糖、麦芽糖都属于单糖 |
19.下面是X和Y反应的微观过程示意图,下列有关说法中不正确的是( )

| A. | 该过程中有极性键的断裂和形成 | B. | 该过程中的X和Y均为活化分子 | ||
| C. | 加入催化剂能增大X和Y分子的能量 | D. | 该过程不能消除大气污染物 |
7.下列离子方程式书写正确的是( )
| A. | 氯气溶于水:Cl2+H2O═2H++Cl-+ClO- | |
| B. | 硫酸铝溶液中加入足量氨水:Al3++4OH-═AlO${\;}_{2}^{-}$+2H2O | |
| C. | FeSO4溶液与稀硝酸反应:3Fe2++NO${\;}_{3}^{-}$+4H+═3Fe3++NO↑+2H2O | |
| D. | 碳酸氢铵和足量氢氧化钠溶液反应:NH${\;}_{4}^{+}$+OH-═NH3•H2O |
4.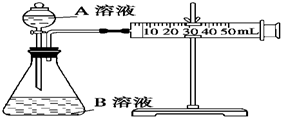 甲、乙、丙三个实验小组利用KMnO4酸性溶液与H2C2O4溶液反应研究影响反应速率的因素.设计实验方案如下(实验中所用KMnO4溶液均已加入H2SO4):
甲、乙、丙三个实验小组利用KMnO4酸性溶液与H2C2O4溶液反应研究影响反应速率的因素.设计实验方案如下(实验中所用KMnO4溶液均已加入H2SO4):
甲组:通过测定生成CO2气体体积的方法来比较化学反应速率的大小.
实验装置如图,实验时分液漏斗中A溶液一次性放下.
A、B的成分见下表:
(1)甲组同学实验探究的是浓度对化学反应速率的影响.
结合装置,分析所给实验仪器,定量比较①②组化学反应速率大小实现该实验目的还欠缺的仪器:秒表.
乙组通过测定单位时间内KMnO4溶液浓度变化来判定反应速率快慢.所用的试剂以及条件如下表所示:
(2)①乙组同学实验目的是探究对化学反应速率的影响.
②写出溶液中发生的反应的离子方程式(提示:H2C2O4为弱酸,KMnO4的还原产物为Mn2+):2MnO4-+5H2C2O4+6H+=2Mn2++l0CO2↑+8H2O.实验中该组同学始终没有看到溶液褪色,其原因是高锰酸钾过量.
丙组:丙组通过测定单位时间KMnO4溶液浓度变化来判定反应速率快慢.在25℃时,40mL 0.001mol/LKMnO4与38mL0.1mol/LH2C2O4和2mL2.38mol/LH2SO4混合液共80mL中KMnO4的浓度及对应时段的平均反应速率数据:
(3)完成上表中a=0.11 mol/(L•min).
问题讨论:已知该实验过程中溶液温度几乎不变,但是依据实验数据发现开始阶段速率却在增大.
你认为引起该反应速率增大的因素是反应过程中产生了催化剂加快了反应速率.
 甲、乙、丙三个实验小组利用KMnO4酸性溶液与H2C2O4溶液反应研究影响反应速率的因素.设计实验方案如下(实验中所用KMnO4溶液均已加入H2SO4):
甲、乙、丙三个实验小组利用KMnO4酸性溶液与H2C2O4溶液反应研究影响反应速率的因素.设计实验方案如下(实验中所用KMnO4溶液均已加入H2SO4):甲组:通过测定生成CO2气体体积的方法来比较化学反应速率的大小.
实验装置如图,实验时分液漏斗中A溶液一次性放下.
A、B的成分见下表:
| 序号 | A溶液 | B溶液 |
| ① | 2mL0.1mol/LH2C2O4溶液 | 4mL 0.01mol/L KMnO4溶液 |
| ② | 2mL0.2mol/LH2C2O4溶液 | 4mL 0.01mol/L KMnO4溶液 |
结合装置,分析所给实验仪器,定量比较①②组化学反应速率大小实现该实验目的还欠缺的仪器:秒表.
乙组通过测定单位时间内KMnO4溶液浓度变化来判定反应速率快慢.所用的试剂以及条件如下表所示:
| 序号 | 溶液 | 条件 |
| ③ | 2mL 0.1mol/L H2C2O4和8mL 0.1mol/L KMnO4 | 热水 |
| ④ | 2mL 0.1mol/L H2C2O4和8mL 0.1mol/L KMnO4 | 冷水 |
②写出溶液中发生的反应的离子方程式(提示:H2C2O4为弱酸,KMnO4的还原产物为Mn2+):2MnO4-+5H2C2O4+6H+=2Mn2++l0CO2↑+8H2O.实验中该组同学始终没有看到溶液褪色,其原因是高锰酸钾过量.
丙组:丙组通过测定单位时间KMnO4溶液浓度变化来判定反应速率快慢.在25℃时,40mL 0.001mol/LKMnO4与38mL0.1mol/LH2C2O4和2mL2.38mol/LH2SO4混合液共80mL中KMnO4的浓度及对应时段的平均反应速率数据:
| 时间(min) | 0-4 | 4-8 | 8-12 | 12-16 | 16-21 | 21-22 | 22-23 |
| c(KMnO4)(10-4mol/L) | 4.58 | 4.02 | 3.36 | 2.25 | 0.72 | 0.43 | 0.23 |
| υ(KMnO4)(10-4mol/(L•min) | a | 0.14 | 0.17 | 0.28 | 0.32 | 0.29 | 0.20 |
问题讨论:已知该实验过程中溶液温度几乎不变,但是依据实验数据发现开始阶段速率却在增大.
你认为引起该反应速率增大的因素是反应过程中产生了催化剂加快了反应速率.
2.下列反应过程中的能量变化情况符合图的是( )


| A. | Ba(OH)2•8H2O与NH4C1反应 | B. | 氢气在氯气中燃烧 | ||
| C. | 镁和盐酸的反应 | D. | 钠和水反应 |