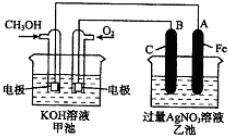
题目内容
7.下列离子方程式书写正确的是( )| A. | 氯气溶于水:Cl2+H2O═2H++Cl-+ClO- | |
| B. | 硫酸铝溶液中加入足量氨水:Al3++4OH-═AlO${\;}_{2}^{-}$+2H2O | |
| C. | FeSO4溶液与稀硝酸反应:3Fe2++NO${\;}_{3}^{-}$+4H+═3Fe3++NO↑+2H2O | |
| D. | 碳酸氢铵和足量氢氧化钠溶液反应:NH${\;}_{4}^{+}$+OH-═NH3•H2O |
分析 A.HClO为弱酸,在离子反应中应保留化学式;
B.一水合氨为弱碱,不能溶解氢氧化铝;
C.硝酸具有氧化性,亚铁离子具有还原性,两者反应发生氧化还原反应,生成三价铁、一氧化氮;
D.漏写碳酸氢根离子与碱的反应.
解答 解:A.氯气与水反应生成盐酸和次氯酸,离子反应为Cl2+H2O?H++Cl-+HClO,故A错误;
B.硫酸铝溶液与氨水反应可生成氢氧化铝沉淀和硫酸铵,氢氧化铝不能溶于弱碱,离子反应为:Al3++3NH3•H2O═Al(OH)3↓+3NH4+,故B错误;
C.FeSO4溶液与稀硝酸反应,亚铁离子被氧化成铁离子、本身被还原成一氧化氮,离子反应为:3Fe2++NO${\;}_{3}^{-}$+4H+═3Fe3++NO↑+2H2O,故C正确;
D.碳酸氢铵溶液和足量氢氧化钠溶液反应的离子反应为HCO3-+NH4++2OH-=NH3•H2O+CO32-+H2O,故D错误;
故选C.
点评 本题考查离子反应的书写,明确发生的化学反应是解答本题的关键,注意B量多无影响,D漏写碳酸氢根离子与碱的反应,题目难度不大.

练习册系列答案
相关题目
16.下列物质中,既能与盐酸反应,又能与氢氧化钠溶液反应的是( )
① ②NaHCO3 ③Al ④
②NaHCO3 ③Al ④ ⑤Al2(SO4)3.
⑤Al2(SO4)3.
①
 ②NaHCO3 ③Al ④
②NaHCO3 ③Al ④ ⑤Al2(SO4)3.
⑤Al2(SO4)3.| A. | ①③ | B. | ③⑤ | C. | ①②③ | D. | ①③④ |
14.下列混合物分离方法、原理都正确的是( )
| 分离方法 | 原理 | |
| A | 除去乙烯中乙炔:通入酸性高锰酸钾溶液中洗气 | 乙炔能与酸性高锰酸钾溶液反应,而乙烯不反应 |
| B | 分离硝基苯和苯:蒸馏 | 硝基苯和苯的沸点不同 |
| C | 除去丁酸乙酯中乙醇:加入饱和碳酸钠溶液,蒸馏 | 乙醇和丁酸乙酯的沸点不同 |
| D | 用丙醇和氯仿萃取碘水中碘 | 碘易溶于丙醇、氯仿 |
| A. | A | B. | B | C. | C | D. | D |
12. 草酸亚铁晶体(FeC2O4•2H2O)呈淡黄色.某课题组为探究草酸亚铁晶体的化学性质,进行了一系列实验探究.
草酸亚铁晶体(FeC2O4•2H2O)呈淡黄色.某课题组为探究草酸亚铁晶体的化学性质,进行了一系列实验探究.
(1)向盛有草酸亚铁晶体的试管中滴入几滴硫酸酸化的KMnO4溶液,振荡,发现溶液颜色逐渐变为棕黄色,并检测到二氧化碳气体生成.这说明草酸亚铁晶体具有还原性(填“氧化性”、“还原性”或“碱性”).若反应中消耗1mol FeC2O4•2H2O,则参加反应的KMnO4为0.6mol.
(2)资料表明:在密闭容器中加热到一定温度时,草酸亚铁晶体可完全分解,生成几种氧化物,残留物为黑色固体.课题组根据课本上所介绍的铁的氧化物的性质,对黑色固体的组成提出如下假设,请你完成假设二和假设三:
假设一:全部是FeO
假设二:全部是四氧化三铁
假设三:
(3)为验证上述假设一是否成立,课题组进行如下研究.
【定性研究】请你完成表中内容.
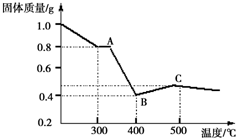
【定量研究】课题组在文献中查阅到,FeC2O4•2H2O受热分解时,固体质量随温度变化的曲线如图所示,写出加热到400℃时,FeC2O4•2H2O晶体受热分解得到的固体产物的化学式为:FeC2O4•2H2O$\frac{\underline{\;\;△\;\;}}{\;}$FeO+CO↑+CO2↑+2H2O.
 草酸亚铁晶体(FeC2O4•2H2O)呈淡黄色.某课题组为探究草酸亚铁晶体的化学性质,进行了一系列实验探究.
草酸亚铁晶体(FeC2O4•2H2O)呈淡黄色.某课题组为探究草酸亚铁晶体的化学性质,进行了一系列实验探究.(1)向盛有草酸亚铁晶体的试管中滴入几滴硫酸酸化的KMnO4溶液,振荡,发现溶液颜色逐渐变为棕黄色,并检测到二氧化碳气体生成.这说明草酸亚铁晶体具有还原性(填“氧化性”、“还原性”或“碱性”).若反应中消耗1mol FeC2O4•2H2O,则参加反应的KMnO4为0.6mol.
(2)资料表明:在密闭容器中加热到一定温度时,草酸亚铁晶体可完全分解,生成几种氧化物,残留物为黑色固体.课题组根据课本上所介绍的铁的氧化物的性质,对黑色固体的组成提出如下假设,请你完成假设二和假设三:
假设一:全部是FeO
假设二:全部是四氧化三铁
假设三:
(3)为验证上述假设一是否成立,课题组进行如下研究.
【定性研究】请你完成表中内容.
| 实验步骤(不要求写出具体操作过程) | 预期实验现象和结论 |
| 取少量黑色固体,加入适量稀盐酸或稀硫酸,在溶液中加入硫氰化钾溶液 | 溶液不变红色,则假设一成立,溶液变成红色,则假设一不成立 |
16.下列说法中正确的是( )
| A. | 将pH=3和pH=5的硫酸溶液等体积混合,所得溶液的pH约为3.3 | |
| B. | 1 L 0.5 mo1•L-1稀硫酸与1 L 1 mo1•L-1NaOH溶液混合反应放出57.3 kJ的热量,则表示中和热的热化学方程式为: H2SO4(aq)+2NaOH(aq)=Na2SO4(aq)+2H2O(1),△H=-114.6 kJ•mo1-l | |
| C. | 已知室温时,0.1 mol•L-1某一元酸HA的电离平衡常数约为1×10-7,则该酸的电离度为0.01% | |
| D. | 已知常温下Ag2CrO4的Ksp=1.12×10-12.将等体积的2×10-4mol•L-1 AgNO3溶液和2×10-4 mol•L-1 K2CrO4溶液混合,则有Ag2CrO4沉淀产生 |
17.下列各组元素的性质递变情况错误的是( )
| A. | N、O、F原子最外层电子数依次增加 | B. | P、S、Cl原子半径依次减小 | ||
| C. | Na、Mg、Al元素第一电离能依次升高 | D. | Li、Na、K的金属性依次增强 |

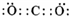 .
.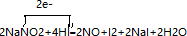 .
.