题目内容
8.下列关于SO2性质的说法不正确的是( )| A. | 能形成酸雨 | B. | 能使鲜花褪色 | ||
| C. | 是无色无味的气体 | D. | 能与NaOH溶液反应 |
分析 二氧化硫为酸性氧化物,具有漂白性,为无色有刺激性气体有毒气体,据此解答.
解答 解:A.二氧化硫与水反应生成亚硫酸,亚硫酸溶于水显酸性,二氧化硫为酸雨形成主要原因之一,故A正确;
B.二氧化硫具有漂白性,能够使鲜花褪色,故B正确;
C.二氧化硫是无色有刺激性气体有毒气体,故C错误;
D.二氧化硫为酸性氧化物,能够与氢氧化钠反应生成亚硫酸钠和水,故D正确;
故选:C.
点评 本题考查了元素化合物知识,侧重考查二氧化硫的性质,熟悉二氧化硫的漂白性、酸性氧化物的性质是解题关键,注意酸雨形成原因.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
6.Na2SO3和NaHSO3在工业上均有广泛用途,下列有关离子方程式正确的是( )
| A. | 用Na2SO3制备少量SO2:SO${\;}_{3}^{2-}$+2H+═SO2↑+H2O | |
| B. | Na2SO3溶液使酚酞试剂变红:SO${\;}_{3}^{2-}$+H2O═OH-+HSO${\;}_{3}^{-}$ | |
| C. | 用Ba(NO3)2溶液检验HSO${\;}_{3}^{-}$:HSO${\;}_{3}^{-}$+Ba2+═BaSO3↓+H+ | |
| D. | 用NaHSO3溶液检验H2S气体:2H2S+H++HSO${\;}_{3}^{-}$═3S↓+3H2O |
16.下列物质属于离子化合物的是( )
| A. | N2 | B. | NH4Cl | C. | H2O | D. | H2SO4 |
3.下列有机反应属于加成反应的是( )
| A. | 2CH3CH2OH+2Na-→2CH3CH2ONa+H2↑ | |
| B. | CH3COOCH2CH3+H2O$?_{△}^{稀硫酸}$CH3COOH+CH3CH2OH | |
| C. | CH2═CH2+Br2-→CH2BrCH2Br | |
| D. | 2CH3CHO+O2$\stackrel{催化剂}{→}$2CH3COOH |
17.下列说法正确的是( )
| A. | 分子式分别为C2H6和C4H10的两种有机化合物一定互为同系物 | |
| B. | 某反应过程中的能量变化如图所示,可见催化剂能改变该反应的焓变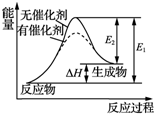 | |
| C. | 非金属氧化物一定是酸性氧化物 | |
| D. | 1 mol N2与3 mol H2在一定条件下充分反应可得2 mol NH3 |
18.下列各组气体中,在通常状况下能共存,并且都能用浓硫酸干燥的是( )
| A. | SO2、H2S、Cl2 | B. | SO2、O2、NH3 | C. | HCl、HBr、HI | D. | SO2、CO2、O2 |
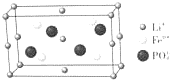 锂的某些化合物是性能优异的材料.请回答:
锂的某些化合物是性能优异的材料.请回答: