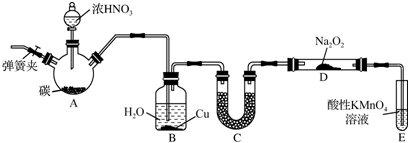
题目内容
20. 锂的某些化合物是性能优异的材料.请回答:
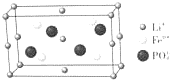
锂的某些化合物是性能优异的材料.请回答:(1)如图是某电动汽车电池正极材料的晶胞结构示意图,其化学式为LiFePO4,其中Fen+的基态电子排布式为[Ar]3d6 ,PO43-的空间构型为正四面体.
(2)Li与Na中第一电离能较小的元素是Na;LiF与NaCl晶体中熔点较高的是LiF.
(3)氮化锂是一种良好的储氢材料,其在氢气中加热时可吸收氢气得到氨基锂(LiNH2)和氢化锂,氢化锂的电子式为Li+[:H]-,上述反应的化学方程式为Li3N+2H2=LiNH2+2LiH.
(4)金属锂为体心立方晶胞,其配位数为8;若其晶胞边长为a pm,则锂晶体中原子的空间占有率是68%.
(5)有机锂试剂在有机合成中有重要应用,但极易与O2、CO2等反应.下列说法不正确的是C(填字母序号).
A.CO2中σ键与π键的数目比为1:1
B.游离态和化合态锂元素均可由特征发射光谱检出
C.叔丁基锂(C4H9Li)中碳原子的杂化轨道类型为sp3和sp2.
分析 (1)根据均摊法计算晶胞中Li+、Fen+、PO43-离子数目,结合化合价代数和为0计算n的值,进而确定化学式,结合核外电子排布规律书写Fen+的核外电子排布式,PO43-中P原子孤电子对数=$\frac{5+3-2×4}{2}$=0,价层电子对数=4+0=4,空间构型为正四面体;
(2)同主族自上而下第一电离能减小;离子所带电荷相同,离子半径越小,晶格能越大,离子晶体的熔沸点越高;
(3)氢化锂属于离子化合物,由锂离子与氢负离子构成,氮化锂在氢气中加热时可吸收氢气得到氨基锂(LiNH2)和氢化锂;
(4)金属锂为体心立方晶胞,体心Li原子与晶胞顶点Li原子相邻;根据均摊法计算晶胞中Li原子数目,晶胞体对角线长度为Li原子半径的4倍,晶胞体对角线长度为晶胞棱长的$\sqrt{3}$倍,设Li原子半径为r,计算晶胞中含有Li原子总体积、晶胞体积,原子的空间占有率=$\frac{原子总体积}{晶胞体积}$×100%;
(5)A.CO2的结构简式为O=C=O,单键为σ键,双键含有1个σ键、1个π键;
B.每种原子都有自己的特征谱线,游离态和化合态锂元素均可由特征发射光谱检出;
C.叔丁基锂(C4H9Li)中碳原子的杂化轨道数目均为4.
解答 解:(1)根据均摊法可知,晶胞中Li+数目为1+8×$\frac{1}{8}$+2×$\frac{1}{2}$+4×$\frac{1}{4}$=4,Fen+数目为4,PO43-离子数目为4,根据化合价代数和为0,可知n=2,故化学式为:LiFePO4,Fe2+的核外电子排布式为[Ar]3d6 ,PO43-中P原子孤电子对数=$\frac{5+3-2×4}{2}$=0,价层电子对数=4+0=4,空间构型为正四面体;
故答案为:LiFePO4;[Ar]3d6 ;正四面体;
(2)同主族自上而下第一电离能减小,故第一电离能Li>Na,离子所带电荷相同,离子半径Li+<Na+、F-<Cl-,故LiF的晶格能大于NaCl的,故LiF的沸点较高,
故答案为:Na;LiF;
(3)氢化锂属于离子化合物,由锂离子与氢负离子构成,电子式为Li+[:H]-,氮化锂在氢气中加热时可吸收氢气得到氨基锂(LiNH2)和氢化锂,反应方程式为:Li3N+2H2=LiNH2+2LiH,
故答案为:Li+[:H]-;Li3N+2H2=LiNH2+2LiH;
(4)金属锂为体心立方晶胞,体心Li原子与晶胞顶点Li原子相邻,则配位数为8;算晶胞中Li原子数目为8×$\frac{1}{8}$+1=2,晶胞体对角线长度为Li原子半径的4倍,晶胞体对角线长度为晶胞棱长的$\sqrt{3}$倍,设Li原子半径为r,则晶胞棱长为$\frac{4r}{\sqrt{3}}$,故原子的空间占有率=$\frac{2×\frac{4}{3}π{r}^{3}}{(\frac{4r}{\sqrt{3}})^{3}}$×100%=68%
故答案为:68%;
(5)A.CO2的结构简式为O=C=O,单键为σ键,双键含有1个σ键、1个π键,σ键与π键的数目比为1:1
,故A正确;
B.每种原子都有自己的特征谱线,游离态和化合态锂元素均可由特征发射光谱检出,故B正确;
C.叔丁基锂(C4H9Li)中碳原子的杂化轨道数目均为4,碳原子采取sp3杂化,故C错误,
故选:C.
点评 本题是对物质结构与性质的考查,涉及晶胞计算、核外电子排布、空间构型与杂化方式判断等,(4)中空间利用率的计算为易错点,关键是确定原子半径与晶胞棱长关系.

 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案| A. | 分子中所有原子都有可能处于同一平面上 | |
| B. | 都能在空气中燃烧,且燃烧时均伴有黑烟 | |
| C. | 都能被KMnO4酸性溶液氧化而使其褪色 | |
| D. | 都能与足量的溴水发生加成反应生成相同的四溴代烷 |

| A. | 碳 | B. | 硅 | C. | 银 | D. | 铝 |
| A. | 能形成酸雨 | B. | 能使鲜花褪色 | ||
| C. | 是无色无味的气体 | D. | 能与NaOH溶液反应 |
| A. | 工业上利用电解法冶炼铝和铁 | |
| B. | 生产和生活中常用可溶性铝盐和铜盐净水 | |
| C. | 工业合成氨的反应属于能自发进行的反应,故能迅速发生 | |
| D. | 热的纯碱溶液清洗带油污的餐具与盐类和酯类的水解均有关 |
| A. | 元素的第一电离能越大,其金属性越强 | |
| B. | 元素的第一电离能越小,其金属性越强 | |
| C. | 金属单质跟酸反应的难易,只跟该金属元素的第一电离能有关 | |
| D. | 同周期元素,第一电离能随原子序数增大逐渐增大 |
 某探究小组设计如图所示装置(夹持、加热仪器略),模拟工业生产进行制备三氯乙醛(CCl3CHO)的实验.查阅资料,有关信息如下:
某探究小组设计如图所示装置(夹持、加热仪器略),模拟工业生产进行制备三氯乙醛(CCl3CHO)的实验.查阅资料,有关信息如下:①制备反应原理:C2H5OH+4Cl2→CCl3CHO+5HCl
可能发生的副反应:C2H5OH+HCl→C2H5Cl+H2O
CCl3CHO+HClO→CCl3COOH+HCl
(三氯乙酸)
②相关物质的相对分子质量及部分物理性质:
| C2H5OH | CCl3CHO | CCl3COOH | C2H5Cl | |
| 相对分子质量 | 46 | 147.5 | 163.5 | 64.5 |
| 熔点/℃ | -114.1 | -57.5 | 58 | -138.7 |
| 沸点/℃ | 78.3 | 97.8 | 198 | 12.3 |
| 溶解性 | 与水互溶 | 可溶于水、乙醇 | 可溶于水、乙醇、三氯乙醛 | 微溶于水,可溶于乙醇 |
(2)装置B中的试剂是饱和食盐水,若撤去装置B,可能导致装置D中副产物C2H5Cl(填化学式)的量增加;装置D可采用水浴加热的方法以控制反应温度在70℃左右.
(3)装置中球形冷凝管的作用为冷凝回流 写出E中所有可能发生的无机反应的离子方程式Cl2+2OH-=Cl-+ClO-+H2O、H++OH-=H2O.
(4)反应结束后,有人提出先将D中的混合物冷却到室温,再用过滤的方法分离出CCl3COOH.你认为此方案是否可行不可行,为什么:CCl3COOH溶于乙醇与CCl3CHO.
(5)测定产品纯度:称取产品0.40g配成待测溶液,加入0.1000mol•L-1碘标准溶液20.00mL,再加入适量Na2CO3溶液,反应完全后,加盐酸调节溶液的pH,立即用0.02000mol•L-1Na2S2O3溶液滴定至终点.进行三次平行实验,测得消耗Na2S2O3溶液20.00mL.则产品的纯度为66.4%.(计算结果保留三位有效数字)
滴定的反应原理:CCl3CHO+OH-═CHCl3+HCOO-
HCOO-+I2═H++2I-+CO2↑
I2+2S2O32-═2I-+S4O62-
(6)为证明三氯乙酸的酸性比乙酸强,某学习小组的同学设计了以下三种方案,你认为能够达到实验目的是abc
a.分别测定0.1mol•L-1两种酸溶液的pH,三氯乙酸的pH较小
b.用仪器测量浓度均为0.1mol•L-1的三氯乙酸和乙酸溶液的导电性,测得乙酸溶液的导电性弱
c.测定等物质的量浓度的两种酸的钠盐溶液的pH,乙酸钠溶液的pH较大.