题目内容
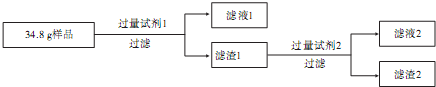
铝碳酸镁[AlaMgb?(CO3)c?(OH)d?eH2O]用于治疗慢性胃炎.称取3.01g铝碳酸镁样品,溶于50ml的2mol/L盐酸(过量),收集到气体112mL(标准状况);往所得溶液中加入40mL的3mol/L NaOH溶液,过滤,将所得沉淀洗涤,干燥,称量得固体1.74g;再将滤液稀释到100mL,测得溶液中OH-的浓度为0.1mol/L,由计算可以确定e的值为 .
考点:有关混合物反应的计算
专题:守恒法
分析:根据生成二氧化碳的量计算出碳酸根离子的物质的量,氢氧化钠过量,生成的沉淀为氢氧化镁,根据n=
计算出氢氧化镁的物质的量,从而得出3.01g样品中含有的镁离子的物质的量;反应后溶质为氯化钠、偏铝酸钠和氢氧化钠,根据电荷守恒计算出偏铝酸根离子的物质的量,从而得出样品中含有铝离子的物质的量;设3.01g样品中含有氢氧根离子的物质的量为xmol,则:n(HCl)-2n(CO32-)-x=n总(OH-)-n剩余(OH-)-2n(Mg2+)-4n(Al3+),据此计算出样品中氢氧根离子的物质的量;然后根据质量守恒计算出3.01g样品中含有水的质量、物质的量,最后根据a:b:c:d:e=n(Al3+):n(Mg2+):n(CO32-):n(OH-):n(H2O)计算出e的值.
| m |
| M |
解答:
解:50mL的2mol/L盐酸中含有HCl的物质的量为:n(HCl)=2mol/L×0.05L=0.1mol,则反应后的溶液中n(Cl-)=0.1mol,
生成二氧化碳的物质的量为:n(CO2)=
=0.005mol,根据C原子守恒,3.01g样品中含有0.005molCO32-;
由于反应后氢氧根离子过量,则1.74g沉淀为氢氧化镁的质量,则氢氧化镁的物质的量为:
=0.03mol,根据质量守恒可知,3.01g样品中镁离子的物质的量为0.03mol;
40mL 3mol?L-1的NaOH溶液中氢氧化钠的物质的量为:3mol/L×0.04L=0.12mol,
反应后溶液中氢氧根离子的物质的量为:n(OH-)=0.1 L×0.1 mol?L-1=0.01mol,
反应后溶液中的溶质为NaCl、NaAlO2、NaOH,根据离子电荷守衡:n(Cl-)+n(OH-)+n(AlO2-)=n(Na+),则:n(AlO2-)=0.12mol-0.1mol-0.01mol=0.01mol,根据质量守恒,3.01g样品中含有铝离子的物质的量为0.01mol;
生成0.05mol二氧化碳需要消耗氯化氢0.1mol,0.01mol铝离子转化成偏铝酸根离子需要消耗0.04mol氢氧根离子,生成0.03mol氢氧化镁沉淀需要消耗0.06mol氢氧根离子,设3.01g样品中含有氢氧根离子的物质的量为x,则:0.1mol-0.01mol-x=0.12mol-0.04-0.06mol-0.01mol,解得:x=0.08mol,
3.01g样品中含有水的质量为3.01g-27g/mol×0.01mol-24g/mol×0.03mol-60g/mol×0.005mol-17g/mol×0.08mol=0.36g,水的物质的量为
=0.02mol,
所以a:b:c:d:e=n(Al3+):n(Mg2+):n(CO32-):n(OH-):n(H2O)=0.01mol:0.03mol:0.005mol:0.08mol:0.02mol=2:6:1:16:4,即:a=2、b=6、c=1、d=16、e=4,
故答案为:4.
生成二氧化碳的物质的量为:n(CO2)=
| 0.112L |
| 22.4L/mol |
由于反应后氢氧根离子过量,则1.74g沉淀为氢氧化镁的质量,则氢氧化镁的物质的量为:
| 1.74g |
| 58g/mol |
40mL 3mol?L-1的NaOH溶液中氢氧化钠的物质的量为:3mol/L×0.04L=0.12mol,
反应后溶液中氢氧根离子的物质的量为:n(OH-)=0.1 L×0.1 mol?L-1=0.01mol,
反应后溶液中的溶质为NaCl、NaAlO2、NaOH,根据离子电荷守衡:n(Cl-)+n(OH-)+n(AlO2-)=n(Na+),则:n(AlO2-)=0.12mol-0.1mol-0.01mol=0.01mol,根据质量守恒,3.01g样品中含有铝离子的物质的量为0.01mol;
生成0.05mol二氧化碳需要消耗氯化氢0.1mol,0.01mol铝离子转化成偏铝酸根离子需要消耗0.04mol氢氧根离子,生成0.03mol氢氧化镁沉淀需要消耗0.06mol氢氧根离子,设3.01g样品中含有氢氧根离子的物质的量为x,则:0.1mol-0.01mol-x=0.12mol-0.04-0.06mol-0.01mol,解得:x=0.08mol,
3.01g样品中含有水的质量为3.01g-27g/mol×0.01mol-24g/mol×0.03mol-60g/mol×0.005mol-17g/mol×0.08mol=0.36g,水的物质的量为
| 0.36g |
| 18g/mol |
所以a:b:c:d:e=n(Al3+):n(Mg2+):n(CO32-):n(OH-):n(H2O)=0.01mol:0.03mol:0.005mol:0.08mol:0.02mol=2:6:1:16:4,即:a=2、b=6、c=1、d=16、e=4,
故答案为:4.
点评:本题考查了混合物反应的计算,题目难度中等,明确发生反应原理为解答关键,注意掌握质量守恒在化学计算中的应用,试题计算量较大,充分考查了学生的分析、理解能力及化学计算能力.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
下列关于16O的叙述正确的是( )
| A、质量数为8 |
| B、质子数为8 |
| C、中子数为16 |
| D、电子数为16 |
根据元素元素周期表和元素周期律分析下面的推断,其中正确的是( )
| A、H2SO3的酸性比HClO的酸性弱 |
| B、CH4、NH3、H2O、HF的热稳定性依次逐渐增强 |
| C、铍(Be)的原子失去电子能力比钙强 |
| D、硫、硒(Se)为同主族元素,非金属性Se比S弱 |
下列关于价电子构型3s23p4的描述正确的是( )
| A、它的元素符号为O |
| B、它的核外电子排布式为1s22s22p63s23p4 |
| C、可以与H2化合生成液态化合物 |
D、其原子轨道式为 |
 短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图所示.下列说法正确的是( )
短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图所示.下列说法正确的是( )| A、元素X与元素Z的最高正化合价之和的数值等于8 |
| B、元素Y、W的气态氢化物的稳定性,前者比后者差 |
| C、元素W的最高价氧化物对应的水化物酸性比Q的强 |
| D、简单离子Y2-和Z3+的离子半径,后者比前者大 |