题目内容
某混合物由Cu、SiO2、Al2O3、Fe2O3中的若干种组成,为探究其组成,某化学小组取样品进行如下实验:
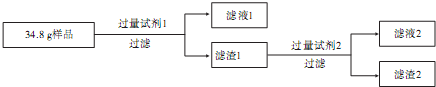
实验中的相关信息如下:
(1)实验一中,滤渣2的成分是 (填化学式),判断依据是 .
(2)混合物中是否含有SiO2? (填“是”或“否”),判断依据是 .
(3)实验二中加入盐酸时发生反应的离子方程式是 、 .
(4)原混合物中各组分的物质的量之比为 .

实验中的相关信息如下:
| 试剂1 | 试剂2 | 滤渣1质量 | 滤渣2质量 | |
| 实验一 | 稀盐酸 | NaOH溶液 | 12.4g | 6.4g |
| 实验二 | NaOH溶液 | 稀盐酸 | 28.8g | 6.4g |
(2)混合物中是否含有SiO2?
(3)实验二中加入盐酸时发生反应的离子方程式是
(4)原混合物中各组分的物质的量之比为
考点:探究物质的组成或测量物质的含量
专题:
分析:(1)实验一中,滤渣1只能是不溶于盐酸的Cu或SiO2中的一种或两种.由于滤渣1与过量氢氧化钠溶液反应后质量减少,说明滤渣1的成分是Cu与SiO2,则滤渣2是Cu;
(2)根据上述分析可知原混合物中含有SiO2,且其质量为12.4g-6.4g=6.0g,物质的量为0.1mol;
(3)原混合物中,不溶于氢氧化钠溶液有Cu或Fe2O3,即实验二中滤渣1可能是Cu或Fe2O3中的一种或两种.滤渣1中加入过量盐酸,质量减少但仍有固体剩余,说明滤渣1中同时含有Cu和Fe2O3.则实验一中加入盐酸时,首先发生Fe2O3+6H+=2Fe3++3H2O,继而发生2Fe3++Cu=Cu2++2Fe2+;
(4)滤渣2是发生(3)题所述反应后剩余的Cu,则原混合物中加入盐酸时反应掉的Cu和Fe2O3共有28.8g-6.4g=22.4g.根据上述方程式可知反应用去的Cu与Fe2O3的物质的量相等,设其物质的量均为x,则64g?mol-1x+160g?mol-1x=22.4g,解得x=0.1mol,即样品中含有0.1molFe2O3.剩余的6.4gCu的物质的量为0.1mol,则样品中Cu为0.2mol.由样品质量知原混合物中没有Al2O3,故n(Fe2O3):n(Cu):n(SiO2)=0.1:0.2:0.1=1:2:1.
(2)根据上述分析可知原混合物中含有SiO2,且其质量为12.4g-6.4g=6.0g,物质的量为0.1mol;
(3)原混合物中,不溶于氢氧化钠溶液有Cu或Fe2O3,即实验二中滤渣1可能是Cu或Fe2O3中的一种或两种.滤渣1中加入过量盐酸,质量减少但仍有固体剩余,说明滤渣1中同时含有Cu和Fe2O3.则实验一中加入盐酸时,首先发生Fe2O3+6H+=2Fe3++3H2O,继而发生2Fe3++Cu=Cu2++2Fe2+;
(4)滤渣2是发生(3)题所述反应后剩余的Cu,则原混合物中加入盐酸时反应掉的Cu和Fe2O3共有28.8g-6.4g=22.4g.根据上述方程式可知反应用去的Cu与Fe2O3的物质的量相等,设其物质的量均为x,则64g?mol-1x+160g?mol-1x=22.4g,解得x=0.1mol,即样品中含有0.1molFe2O3.剩余的6.4gCu的物质的量为0.1mol,则样品中Cu为0.2mol.由样品质量知原混合物中没有Al2O3,故n(Fe2O3):n(Cu):n(SiO2)=0.1:0.2:0.1=1:2:1.
解答:
解:(1)分析过程可知,滤渣1只能是不溶于盐酸的Cu或SiO2中的一种或两种.由于滤渣1与过量氢氧化钠溶液反应后质量减少,说明滤渣1的成分是Cu与SiO2,则滤渣2是Cu.只有Cu既不溶于盐酸,又不溶于NaOH溶液;
故答案为:Cu;只有Cu既不溶于盐酸,又不溶于NaOH溶液;
(2)根据上述分析可知,实验一中滤渣1溶于NaOH溶液后质量减少,原混合物中含有SiO2,且其质量为12.4g-6.4g=6.0g,物质的量为0.1mol;
故答案为:是;实验一中滤渣1溶于NaOH溶液后质量减少;
(3)原混合物中,不溶于氢氧化钠溶液有Cu或Fe2O3,即实验二中滤渣1可能是Cu或Fe2O3中的一种或两种.滤渣1中加入过量盐酸,质量减少但仍有固体剩余,说明滤渣1中同时含有Cu和Fe2O3.则实验一中加入盐酸时,首先发生Fe2O3+6H+=2Fe3++3H2O,继而发生2Fe3++Cu=Cu2++2Fe2+;
故答案为:Fe2O3+6H+=2Fe3++3H2O;2Fe3++Cu=Cu2++2Fe2+;
(4)滤渣2是发生(3)题所述反应后剩余的Cu,则原混合物中加入盐酸时反应掉的Cu和Fe2O3共有28.8g-6.4g=22.4g.根据上述方程式可知反应用去的Cu与Fe2O3的物质的量相等,设其物质的量均为x,则64g?mol-1x+160g?mol-1x=22.4g,解得x=0.1mol,即样品中含有0.1molFe2O3.剩余的6.4gCu的物质的量为0.1mol,则样品中Cu为0.2mol.由样品质量知原混合物中没有Al2O3,故n(Fe2O3):n(Cu):n(SiO2)=0.1:0.2:0.1=1:2:1;
故答案为:1;2:1.
故答案为:Cu;只有Cu既不溶于盐酸,又不溶于NaOH溶液;
(2)根据上述分析可知,实验一中滤渣1溶于NaOH溶液后质量减少,原混合物中含有SiO2,且其质量为12.4g-6.4g=6.0g,物质的量为0.1mol;
故答案为:是;实验一中滤渣1溶于NaOH溶液后质量减少;
(3)原混合物中,不溶于氢氧化钠溶液有Cu或Fe2O3,即实验二中滤渣1可能是Cu或Fe2O3中的一种或两种.滤渣1中加入过量盐酸,质量减少但仍有固体剩余,说明滤渣1中同时含有Cu和Fe2O3.则实验一中加入盐酸时,首先发生Fe2O3+6H+=2Fe3++3H2O,继而发生2Fe3++Cu=Cu2++2Fe2+;
故答案为:Fe2O3+6H+=2Fe3++3H2O;2Fe3++Cu=Cu2++2Fe2+;
(4)滤渣2是发生(3)题所述反应后剩余的Cu,则原混合物中加入盐酸时反应掉的Cu和Fe2O3共有28.8g-6.4g=22.4g.根据上述方程式可知反应用去的Cu与Fe2O3的物质的量相等,设其物质的量均为x,则64g?mol-1x+160g?mol-1x=22.4g,解得x=0.1mol,即样品中含有0.1molFe2O3.剩余的6.4gCu的物质的量为0.1mol,则样品中Cu为0.2mol.由样品质量知原混合物中没有Al2O3,故n(Fe2O3):n(Cu):n(SiO2)=0.1:0.2:0.1=1:2:1;
故答案为:1;2:1.
点评:本题考查了物质组成的实验探究和实验分析判断方法,掌握基础是解题关键,题目难度中等.

练习册系列答案
相关题目
现有乙酸和两种链状单烯烃混合物,其中氧的质量分数为a,则碳的质量分数是( )
A、
| ||
B、
| ||
C、
| ||
D、
|
一定温度时,向容积为2L的密闭容器中充入一定量的SO2和O2,发生反应2SO2(g)+O2(g)?2SO3(g)△H=-196kJ?moL-1,一段时间后达平衡,反应过程中测定的部分数据见下表:下列说法不正确的是( )
| 反应时间/min | n(SO2)/mol | n(O2)/mol |
| 0 | 2 | 1 |
| 5 | 1.2 | |
| 10 | 0.4 | |
| 15 | 0.8 |
| A、反应在前5min的平均速率为v (SO2)=0.08mol?L-1?min-1 |
| B、保持温度不变,向平衡后的容器中再充入1molSO2和0.5molO2时,v (正)>v (逆) |
| C、该温度,反应的平衡常数为11.25L?mol-1 |
| D、相同温度下,起始时向容器中充入1.5mol SO3,达平衡时SO3的转化率为40% |
下列物质不能与氢氧化钠溶液反应的是( )
| A、Al |
| B、Fe2O3 |
| C、Al(OH)3 |
| D、NaHCO3 |


 硫酸铝铵[Ala(NH4)b(SO4)c.xH2O]又叫做明矾、宝石明矾,其相对分子质量为906,常用作净水剂和制造人工刚玉(γ-Al2O3),
硫酸铝铵[Ala(NH4)b(SO4)c.xH2O]又叫做明矾、宝石明矾,其相对分子质量为906,常用作净水剂和制造人工刚玉(γ-Al2O3),