题目内容
下列装置或操作能达到实验目的是( )
A、 除去乙醇中的乙酸 |
B、 形成原电池 |
C、 制取乙酸乙酯 |
D、 甲烷的取代反应 |
考点:分液和萃取,原电池和电解池的工作原理,甲烷的化学性质,乙酸乙酯的制取
专题:实验评价题
分析:A.分液漏斗分离能分层的物质;
B.酒精是非电解质,不导电;
C.乙醇和乙酸在浓硫酸作用下加热发生酯化反应生成乙酸乙酯,饱和碳酸钠可除杂并降低乙酸乙酯的溶解度;
D.甲烷与氯气在光照条件下能发生取代反应.
B.酒精是非电解质,不导电;
C.乙醇和乙酸在浓硫酸作用下加热发生酯化反应生成乙酸乙酯,饱和碳酸钠可除杂并降低乙酸乙酯的溶解度;
D.甲烷与氯气在光照条件下能发生取代反应.
解答:
解:A.乙醇和乙酸互溶,不分层,不能用分液漏斗分离,故A错误;
B.酒精是非电解质,不导电,不能形成原电池,故B错误;
C.乙醇和乙酸在浓硫酸作用下加热发生酯化反应生成乙酸乙酯,饱和碳酸钠可除杂并降低乙酸乙酯的溶解度,装置合理,故C正确;
D.氯气在饱和食盐水中的溶解度较小,甲烷与氯气在光照条件下能发生取代反应,故D正确.
故选CD.
B.酒精是非电解质,不导电,不能形成原电池,故B错误;
C.乙醇和乙酸在浓硫酸作用下加热发生酯化反应生成乙酸乙酯,饱和碳酸钠可除杂并降低乙酸乙酯的溶解度,装置合理,故C正确;
D.氯气在饱和食盐水中的溶解度较小,甲烷与氯气在光照条件下能发生取代反应,故D正确.
故选CD.
点评:本题考查化学实验方案的评价,为高频考点,涉及物质制备、混合物分离提纯以及原电池等,把握实验原理及实验装置的作用为解答的关键,注意实验操作的可行性、评价性分析,题目难度不大.

练习册系列答案
 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案
相关题目
已知铅+2价稳定,+4价铅有很强的氧化性,今有6种下列物质:H2O、PbO2、Pb(NO3)2、HMnO4、HNO3和Mn(NO3)2组成一个化学方程式.下列有关说法正确的是( )
| A、反应物中发生氧化反应的物质PbO2 |
| B、被还原的元素是Mn(NO3)2中Mn |
| C、反应中1mol氧化剂得到5mol电子 |
| D、请将反应物配平后的PbO2与Mn(NO3)2系数之比5:2 |
下列反应的离子方程式正确的是( )
| A、氯气通人含等物质的量的FeBr2溶液中:2Fe2++2Br-+2Cl2=2Fe3++4Cl-+Br2 |
| B、澄清石灰水与少量的碳酸氢钠溶液反应:Ca2++2OH-+2HCO3-=CaCO3↓+CO32-+2H2O |
| C、铜与浓硝酸反应:3Cu+2NO3-+8H+=3Cu2++2NO↑+4H2O |
| D、硫酸氢钠溶液滴入Ba(OH)2溶液至中性:H++SO42-+Ba2++OH-=BaSO4↓+H2O |
下列说法正确的是( )
A、按系统命名法, 的名称为2,4,5-三甲基己烷 的名称为2,4,5-三甲基己烷 |
B、分子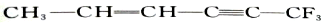 中,位于同一平面上碳原子最多有6个 中,位于同一平面上碳原子最多有6个 |
C、化合物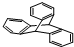 是苯的同系物 是苯的同系物 |
| D、3-甲基-3-乙基戊烷的一氯取代产物有6种 |
设NA为阿伏加德罗常数.下列说法正确的是( )
| A、1L 1mol?L-1的NaClO 溶液中含有ClO-的数目为NA |
| B、1mol Mg在空气中燃烧被完全氧化生成MgO和Mg3N2,失去2NA个电子 |
| C、标准状况下,22.4L苯含有1NA个苯分子 |
| D、1mol的羟基与1mol的氢氧根离子所含电子数均为9NA |
中和滴定是一种操作简单,准确度高的定量分析方法.实际工作中也可利用物质间的氧化还原反应、沉淀反应进行类似的滴定分析,下列有关几种具体的滴定分析(待测液置于锥形瓶内)的说法不正确的是( )
| A、用标准酸性KMnO4溶液滴定Na2SO3溶液以测量其浓度:滴定终点时,溶液由无色变为紫红色 |
| B、利用“Ag++SCN-═AgSCN↓”反应,用标准KSCN溶液测量AgNO3溶液浓度时可用Fe(NO3)3作指示剂 |
| C、利用“2Fe3++2I-═I2+2Fe2+”,用FeCl3溶液测量KI样品中KI的百分含量时可用淀粉作指示剂 |
| D、用标准NaOH溶液测量某盐酸溶液的浓度时,若用酚酞作指示剂,当观察到溶液由无色变红色,且半分钟不恢复时达到滴定终点 |