题目内容
下表是元素周期表的一部分.表中所列的字母分别代表某一化学元素.
(1)如果给核外电子足够的能量,这些电子便会摆脱原子核的束缚而离去.核外电子离开该原子或离子所需要的能量主要受两大因素的影响:A.原子核对核外电子的吸引力 B.形成稳定结构的倾向.下表是一些气态原子失去核外不同电子所需的能量(kJ?mol-1):
①X为以上14种元素中的一种,X和e按2:1形成的化合物化学式为 .
②Y是周期表中 族元素.
③以上14种元素中, (填写字母)元素原子失去核外第一个电子需要的能量最多.
④d,e,l三种元素组成的一种化合物的化学式为NOCl,各原子均满足8e-稳定结构,且无配位键,则其结构式为 .由以上14种元素组成与其互为等电子体的一种常见的单质的化学式为 和一种化合物的化学式为
⑤c,e,l三种元素组成的一种化合物的化学式为COCl2俗称光气,分子中C原子采取 杂化成键;分子中的共价键含有 (填标号)
a.2个σ键 b.2个π键 c.1个σ键、2个π键 d.3个σ键、1个π键
(2)人类在使用金属的历史进程中,经历了铜、铁、铝之后,第四种将被广泛应用的金属被科学家预测为是钛(22Ti),它被誉为“未来世纪的金属”.
试回答下列问题:
①Ti元素为以上14种元素中一种,其编号为 (填写字母),其基态原子的价电子层排布图为 ;
②已知Ti3+可形成配位数为6的配合物.现有含钛的两种颜色的晶体,一种为紫色,另一种为绿色,但相关实验证明,两种晶体的组成皆为TiCl3?6H2O.为测定这两种晶体的化学式,设计了如下实验:
a.分别取等质量的两种配合物晶体的样品配成待测溶液;
b.分别往待测溶液中滴入AgNO3溶液,均产生白色沉淀;
c.沉淀完全后分别过滤得两份沉淀,经洗涤干燥后称量,发现绿色晶体的水溶液与AgNO3溶液反应得到的白色沉淀质量为紫色晶体的水溶液反应得到沉淀质量的
.则绿色晶体配合物的化学式为 .
| a | |||||||||||||||||
| b | c | d | e | f | |||||||||||||
| g | h | i | j | k | l | m | |||||||||||
| n | |||||||||||||||||
| 锂 | X | Y | |
| 失去第一个电子 | 519 | 502 | 580 |
| 失去第二个电子 | 7 296 | 4 570 | 1 820 |
| 失去第三个电子 | 11 799 | 6 920 | 2 750 |
| 失去第四个电子 | 9 550 | 11 600 |
②Y是周期表中
③以上14种元素中,
④d,e,l三种元素组成的一种化合物的化学式为NOCl,各原子均满足8e-稳定结构,且无配位键,则其结构式为
⑤c,e,l三种元素组成的一种化合物的化学式为COCl2俗称光气,分子中C原子采取
a.2个σ键 b.2个π键 c.1个σ键、2个π键 d.3个σ键、1个π键
(2)人类在使用金属的历史进程中,经历了铜、铁、铝之后,第四种将被广泛应用的金属被科学家预测为是钛(22Ti),它被誉为“未来世纪的金属”.
试回答下列问题:
①Ti元素为以上14种元素中一种,其编号为
②已知Ti3+可形成配位数为6的配合物.现有含钛的两种颜色的晶体,一种为紫色,另一种为绿色,但相关实验证明,两种晶体的组成皆为TiCl3?6H2O.为测定这两种晶体的化学式,设计了如下实验:
a.分别取等质量的两种配合物晶体的样品配成待测溶液;
b.分别往待测溶液中滴入AgNO3溶液,均产生白色沉淀;
c.沉淀完全后分别过滤得两份沉淀,经洗涤干燥后称量,发现绿色晶体的水溶液与AgNO3溶液反应得到的白色沉淀质量为紫色晶体的水溶液反应得到沉淀质量的
| 2 |
| 3 |
考点:元素周期律和元素周期表的综合应用
专题:元素周期律与元素周期表专题
分析:由元素在周期表中位置,可知a为H、b为Li、c为C、d为N、e为O、f为F、g为Na、h为Mg、i为Al、j为Si、k为S、l为Cl、m为Ar、n为Ti.
(1)上述元素中,Li、X的第二电离都能剧增,故表现+1价,X的第一电离能较低,故X为Na,Y的第三电离能剧增,表现+3价,故Y为Al,
①X和e按2:1形成的化合物为氧化钠;
②主族元素最高正化合价等于族序数(O、F除外);
③以上14种元素中,Ar原子为稳定结构,最难失去电子;
④d,e,l三种元素组成的一种化合物的化学式为NOCl,各原子均满足8e-稳定结构,且无配位键,N原子与O原子之间形成2对共用电子对,N原子与Cl原子之间形成1对共用电子对;
原子总数相同,价电子总数(或电子总数)相同的微粒互为等电子体;
⑤COCl2分子的结构式为 ,根据C原子σ键数目确定原子杂化方式,单键为σ键,双键含有1个σ键、1个π键;
,根据C原子σ键数目确定原子杂化方式,单键为σ键,双键含有1个σ键、1个π键;
(2)①Ti元素为过渡元素,以上14种元素中的n元素,原子核外电子数为22,其价电子排布式为3d24s2,据此画出价电子层排布图;
②Ti3+的配位数均为6,往待测溶液中滴入AgNO3溶液,均产生白色沉淀,则有氯离子在配合物的外界,两份沉淀,经洗涤干燥后称量,发现绿色晶体的水溶液与AgNO3溶液反应得到的白色沉淀质量为紫色晶体的水溶液反应得到沉淀质量的
,可知紫色晶体中含3个氯离子,绿色晶体中含2个氯离子.
(1)上述元素中,Li、X的第二电离都能剧增,故表现+1价,X的第一电离能较低,故X为Na,Y的第三电离能剧增,表现+3价,故Y为Al,
①X和e按2:1形成的化合物为氧化钠;
②主族元素最高正化合价等于族序数(O、F除外);
③以上14种元素中,Ar原子为稳定结构,最难失去电子;
④d,e,l三种元素组成的一种化合物的化学式为NOCl,各原子均满足8e-稳定结构,且无配位键,N原子与O原子之间形成2对共用电子对,N原子与Cl原子之间形成1对共用电子对;
原子总数相同,价电子总数(或电子总数)相同的微粒互为等电子体;
⑤COCl2分子的结构式为
 ,根据C原子σ键数目确定原子杂化方式,单键为σ键,双键含有1个σ键、1个π键;
,根据C原子σ键数目确定原子杂化方式,单键为σ键,双键含有1个σ键、1个π键;(2)①Ti元素为过渡元素,以上14种元素中的n元素,原子核外电子数为22,其价电子排布式为3d24s2,据此画出价电子层排布图;
②Ti3+的配位数均为6,往待测溶液中滴入AgNO3溶液,均产生白色沉淀,则有氯离子在配合物的外界,两份沉淀,经洗涤干燥后称量,发现绿色晶体的水溶液与AgNO3溶液反应得到的白色沉淀质量为紫色晶体的水溶液反应得到沉淀质量的
| 2 |
| 3 |
解答:
解:由元素在周期表中位置,可知a为H、b为Li、c为C、d为N、e为O、f为F、g为Na、h为Mg、i为Al、j为Si、k为S、l为Cl、m为Ar、n为Ti.
(1)上述元素中,Li、X的第二电离都能剧增,故表现+1价,X的第一电离能较低,故X为Na,Y的第三电离能剧增,表现+3价,故Y为Al,
①X和e按2:1形成的化合物为氧化钠,化学式为:Na2O,故答案为:Na2O;
②Y为Al,最高正化合价等于族序数,处于ⅢA族,故答案为:ⅢA;
③以上14种元素中,Ar原子最外层为8电子稳定结构,最难失去电子,其第一电离能最大,为表中m元素,故答案为:m;
④d,e,l三种元素组成的一种化合物的化学式为NOCl,各原子均满足8e-稳定结构,且无配位键,N原子与O原子之间形成2对共用电子对,N原子与Cl原子之间形成1对共用电子对,结构式为O=N-Cl,由以上14种元素组成与NOCl互为等电子体,一种是常见的单质为O3和另一种是化合物为SO2,
故答案为:O=N-Cl;O3;SO2;
由以上14种元素组成与NOCl互为等电子体,一种是常见的单质和另一种是化合物,的化学式为
⑤COCl2分子的结构式为 ,C原子成3个σ键,没有孤电子对,产生sp2杂化方式,单键为σ键,双键含有1个σ键、1个π键,故含有3个σ键、1个π键,故答案为:sp2;c;
,C原子成3个σ键,没有孤电子对,产生sp2杂化方式,单键为σ键,双键含有1个σ键、1个π键,故含有3个σ键、1个π键,故答案为:sp2;c;
(2)①Ti元素为过渡元素,以上14种元素中的n元素,原子核外电子数为22,其价电子排布式为3d24s2,价电子层排布图为,故答案为:n; ;
;
②Ti3+的配位数均为6,往待测溶液中滴入AgNO3溶液,均产生白色沉淀,则有氯离子在配合物的外界,两份沉淀,经洗涤干燥后称量,发现绿色晶体的水溶液与AgNO3溶液反应得到的白色沉淀质量为紫色晶体的水溶液反应得到沉淀质量的
,可知紫色晶体中外界含3个氯离子,绿色晶体中外界含2个氯离子,即绿色晶体的化学式为[TiCl(H2O)5]Cl2?H2O,
故答案为:[TiCl(H2O)5]Cl2?H2O.
(1)上述元素中,Li、X的第二电离都能剧增,故表现+1价,X的第一电离能较低,故X为Na,Y的第三电离能剧增,表现+3价,故Y为Al,
①X和e按2:1形成的化合物为氧化钠,化学式为:Na2O,故答案为:Na2O;
②Y为Al,最高正化合价等于族序数,处于ⅢA族,故答案为:ⅢA;
③以上14种元素中,Ar原子最外层为8电子稳定结构,最难失去电子,其第一电离能最大,为表中m元素,故答案为:m;
④d,e,l三种元素组成的一种化合物的化学式为NOCl,各原子均满足8e-稳定结构,且无配位键,N原子与O原子之间形成2对共用电子对,N原子与Cl原子之间形成1对共用电子对,结构式为O=N-Cl,由以上14种元素组成与NOCl互为等电子体,一种是常见的单质为O3和另一种是化合物为SO2,
故答案为:O=N-Cl;O3;SO2;
由以上14种元素组成与NOCl互为等电子体,一种是常见的单质和另一种是化合物,的化学式为
⑤COCl2分子的结构式为
 ,C原子成3个σ键,没有孤电子对,产生sp2杂化方式,单键为σ键,双键含有1个σ键、1个π键,故含有3个σ键、1个π键,故答案为:sp2;c;
,C原子成3个σ键,没有孤电子对,产生sp2杂化方式,单键为σ键,双键含有1个σ键、1个π键,故含有3个σ键、1个π键,故答案为:sp2;c;(2)①Ti元素为过渡元素,以上14种元素中的n元素,原子核外电子数为22,其价电子排布式为3d24s2,价电子层排布图为,故答案为:n;
 ;
;②Ti3+的配位数均为6,往待测溶液中滴入AgNO3溶液,均产生白色沉淀,则有氯离子在配合物的外界,两份沉淀,经洗涤干燥后称量,发现绿色晶体的水溶液与AgNO3溶液反应得到的白色沉淀质量为紫色晶体的水溶液反应得到沉淀质量的
| 2 |
| 3 |
故答案为:[TiCl(H2O)5]Cl2?H2O.
点评:本题考查是对物质结构的考查,涉及元素周期表、核外电子排布、杂化理论、化学键、等电子体、配合物等知识点,难度中等,注意配合物中内外界的划分.

练习册系列答案
相关题目
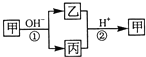 甲是一种常见的单质,乙、丙为中学常见的化合物,甲、乙、丙均含有元素X.它们有如图的转化关系(部分产物及反应条件已略去),下列判断正确的是( )
甲是一种常见的单质,乙、丙为中学常见的化合物,甲、乙、丙均含有元素X.它们有如图的转化关系(部分产物及反应条件已略去),下列判断正确的是( )| A、X元素可能为Al |
| B、X 元素不一定为非金属元素 |
| C、反应①和②互为可逆反应 |
| D、反应①和②一定为氧化还原反应 |
下列装置或操作能达到实验目的是( )
A、 除去乙醇中的乙酸 |
B、 形成原电池 |
C、 制取乙酸乙酯 |
D、 甲烷的取代反应 |
下列各组中的两种物质相互作用时,改变反应条件或反应物的用量,不会影响产物组成的是( )
| A、Na与O2 |
| B、NaOH与CO2 |
| C、NaOH与AlCl3 |
| D、Na2O与CO2 |
下列叙述正确的是( )
| A、能使湿润的淀粉KI试纸变成蓝色的物质一定是Cl2 |
| B、液溴易挥发,在存放液溴的试剂瓶中应加水封存 |
| C、某溶液加入CCl4,CCl4层显紫色,证明原溶液中存在I- |
| D、某溶液加入BaCl2溶液,产生不溶于稀硝酸的白色沉淀,该溶液一定存在Ag+ |
下列各组中的物质或离子都含配位键的是( )
| A、H2O、Al2Cl6 |
| B、CO2、SO42- |
| C、H3O+、[Cu(NH3)4]SO4 |
| D、NH4Cl、C2H2 |