题目内容
15.现有下列反应式,据两式判断,下列各组离子中,氧化性由强到弱的排列顺序正确的是(1)2Fe3++2I-═2Fe2++I2 (2)Br2+2Fe2+═2Fe3++2Br-( )
| A. | Br2>Fe2+>I2 | B. | Br2>Fe3+>I2 | C. | I2>Br2>Fe3+ | D. | Fe3+>Br2>I2 |
分析 根据元素的化合价升高来判断还原剂,利用氧化还原反应中还原剂的还原性大于还原产物的还原性来解答.
解答 解:2Fe3++2I-=2Fe2++I2中,I元素的化合价升高,由还原剂的还原性大于还原产物的还原性,则还原性I->Fe2+,所以氧化性Fe3+>I2;
Br2+2Fe2+=2Fe3++2Br-中,Fe元素的化合价升高,由还原剂的还原性大于还原产物的还原性,则还原性Fe2+>Br-,所以氧化性Br2>Fe3+;
所以离子的还原性由强到弱的顺序为I->Fe2+>Br-,氧化性强弱为:Br2>Fe3+>I2,
故选B.
点评 本题考查离子还原性的比较,明确氧化还原反应中还原剂中元素的化合价升高、还原剂的还原性大于还原产物的还原性,氧化剂的氧化性强于氧化产物的氧化性即可解答.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
5.下列关于蛋白质的叙述中,不正确的是( )
| A. | 天然蛋白质的水解产物是多种a-氨基酸 | |
| B. | 蛋白质溶液里加入饱和硫酸铵溶液,蛋白质会析出,且加水也不溶解 | |
| C. | 重金属盐能使蛋白质凝结,所以误食重金属盐会中毒 | |
| D. | 浓硝酸沾到皮肤上能使浓硝酸和蛋白质发生颜色反应 |
6.常温下,下列离子能使纯水中的H+离子数目增加的是( )
| A. | S2- | B. | HCO3- | C. | Al3+ | D. | K+ |
3.为测定CO2的相对分子质量,某实验小组三位同学选用含NaHCO3的样品(质量均为m1g)和其它合理的试剂,进行了以下三个实验.

完成下列填空:
甲用重量法确定CO2的质量,装置如图1:
(1)B中反应的化学方程式为2NaHCO3+H2SO4=Na2SO4+2CO2↑+2H2O.
(2)实验中持续缓缓通入空气,其作用之一是把生成的CO2全部排入后续装置中,使之完全被吸收;另有作用为搅拌装置B中的反应物,使之充分反应.
(3)不能提高测定精确度的措施是c.
a.向B内加入酸之前,排尽装置内的CO2气体
b.向B内滴加酸时不宜过快
c.在B、C之间增添盛有饱和NaHCO3溶液的洗气装置
d.在D后增添盛有碱石灰的干燥管
(4)乙用滴定法确定CO2的物质的量将样品配制成100mL溶液,从中取出20.00mL,用c mol•L-1的盐酸滴定(甲基橙作指示剂).当溶液由黄色变为橙色,且保持30s不变时,停止滴定.平行测定三次,有关实验数据记录如下表.m1 g样品产生CO2的物质的量为0.125cmol.
(5)丙用气体体积法确定CO2的体积,装置如右上图所示.
①为了减小实验误差,量气管中加入的液体X为饱和碳酸氢钠溶液;
②若该装置气密性良好,读数平视,但测得的“CO2体积”数据仍然偏小,其原因可能是水准管的液面高于量气管中的液面.
(6)确定CO2的相对分子质量,选用甲、乙(限用“甲”、“乙”、“丙”进行填写)的实验数据为最佳.

完成下列填空:
甲用重量法确定CO2的质量,装置如图1:
(1)B中反应的化学方程式为2NaHCO3+H2SO4=Na2SO4+2CO2↑+2H2O.
(2)实验中持续缓缓通入空气,其作用之一是把生成的CO2全部排入后续装置中,使之完全被吸收;另有作用为搅拌装置B中的反应物,使之充分反应.
(3)不能提高测定精确度的措施是c.
a.向B内加入酸之前,排尽装置内的CO2气体
b.向B内滴加酸时不宜过快
c.在B、C之间增添盛有饱和NaHCO3溶液的洗气装置
d.在D后增添盛有碱石灰的干燥管
(4)乙用滴定法确定CO2的物质的量将样品配制成100mL溶液,从中取出20.00mL,用c mol•L-1的盐酸滴定(甲基橙作指示剂).当溶液由黄色变为橙色,且保持30s不变时,停止滴定.平行测定三次,有关实验数据记录如下表.m1 g样品产生CO2的物质的量为0.125cmol.
| 实验编号 | 待测液体积 (mL) | 消耗盐酸体积(mL) | |
| 初读数 | 末读数 | ||
| 1 | 20.00 | 0.00 | 25.02 |
| 2 | 20.00 | 0.20 | 28.80 |
| 3 | 20.00 | 1.30 | 26.28 |
①为了减小实验误差,量气管中加入的液体X为饱和碳酸氢钠溶液;
②若该装置气密性良好,读数平视,但测得的“CO2体积”数据仍然偏小,其原因可能是水准管的液面高于量气管中的液面.
(6)确定CO2的相对分子质量,选用甲、乙(限用“甲”、“乙”、“丙”进行填写)的实验数据为最佳.
10.下列关于金属的叙述中正确的是( )
| A. | 常温下所有的金属都是固态 | |
| B. | 金属具有导电、导热和延展性 | |
| C. | 金属元素的原子只有还原性,离子只有氧化性 | |
| D. | 所有金属元素都以化合态存在于自然界 |
20.下列物质属于非电解质的是( )
| A. | HNO3 | B. | Cu | C. | SO2 | D. | NH4NO3 |
7.下列实验操作或事故处理正确的是( )
| A. | 金属钠着火时可用水扑灭 | |
| B. | 酒精灯着火时用湿抹布扑盖 | |
| C. | 蒸发结晶时,为得到更多晶体直接将溶液蒸干 | |
| D. |  实验室可分别将贴有标志(a)和标志(b)的药品放在同一橱柜中 |
4.下列关于电解质的说法正确的是( )
| A. | 氯化氢气体不能导电,所以氯化氢不是电解质 | |
| B. | SO2溶于水形成的溶液能导电,所以SO2是电解质 | |
| C. | 碳棒能导电但属于非电解质 | |
| D. | 电解质不一定能导电 |
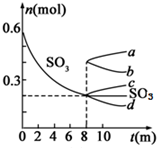 利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤.T1℃时,在1L密闭容器中充入0.6molSO3,如图表示SO3物质的量随时间的变化曲线.
利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤.T1℃时,在1L密闭容器中充入0.6molSO3,如图表示SO3物质的量随时间的变化曲线.