题目内容
20.下列溶液中各微粒的浓度关系正确的是( )| A. | 0.1mol﹒L-1CH3COOH溶液中:c(CH3COO-)+c(OH-)=c(H+) | |
| B. | 0.1mol﹒L-1CuSO4溶液中:c(SO42-)>c(Cu2+)>c(OH-)>c(H+) | |
| C. | 室温下,pH=2的HCl溶液与pH=12的氨水等体积混合后的溶液中:c(Cl-)>c(NH4+) | |
| D. | 物质的量浓度相同的HCl溶液与氨水等体积混合后的溶液中:c(Cl-)=c(NH4+) |
分析 A.根据醋酸溶液中的电荷守恒判断;
B.铜离子部分水解,溶液呈酸性,则c(H+)>c(OH-);
C.一水合氨为弱碱,混合液中氨水过量,溶液呈碱性,则c(OH-)>c(H+),结合电荷守恒判断;
D.反应后溶质为氯化铵,铵根离子部分水解,则c(Cl-)>c(NH4+).
解答 解:A.0.1mol﹒L-1CH3COOH溶液中,根据电荷守恒可知:c(CH3COO-)+c(OH-)=c(H+),故A正确;
B.硫酸铜溶液中,铜离子部分水解,溶液呈酸性,则c(SO42-)>c(Cu2+)、c(H+)>c(OH-),溶液中离子浓度大小为:c(SO42-)>c(Cu2+)>c(H+)>c(OH-),故B错误;
C.室温下,pH=2的HCl溶液与pH=12的氨水等体积混合后的溶液中,由于氨水过量,则混合液呈碱性,则:c(OH-)>c(H+),根据电荷守恒可知c(Cl-)<c(NH4+),故C错误;
D.物质的量浓度相同的HCl溶液与氨水等体积混合,反应后溶质为氯化铵,铵根离子部分水解,导致铵根离子浓度减小,则c(Cl-)>c(NH4+),故D错误;
故选A.
点评 本题考查了离子浓度大小比较,题目难度不大,明确盐的水解原理、电荷守恒的含义及应用方法为解答关键,注意掌握判断离子浓度大小的常用方法,试题有利于提高学生的分析能力及灵活应用能力.

练习册系列答案
 53随堂测系列答案
53随堂测系列答案
相关题目
10.下列事实与胶体性质无关的是( )
| A. | 长江三角洲的形成 | |
| B. | 雾天容易看到车灯形成的光柱 | |
| C. | 将植物油倒入水中用力搅拌形成油水混合物 | |
| D. | 向氢氧化铁胶体中加入硫酸溶液先出现浑浊后变澄清 |
11.H+浓度相同的两份等体积溶液A和B,A为HCl溶液,B为CH3COOH溶液,二者分别和等质量的锌反应,若最后仅有一份溶液中存在锌,则下列说法正确的是( )
①开始时的反应速率:A>B ②参加反应的锌的物质的量:A=B
③反应过程的平均速率:B>A ④A中有锌剩余 ⑤B中有锌剩余.
①开始时的反应速率:A>B ②参加反应的锌的物质的量:A=B
③反应过程的平均速率:B>A ④A中有锌剩余 ⑤B中有锌剩余.
| A. | ③④ | B. | ③⑤ | C. | ①③④ | D. | ①②③ |
8.下列化工生产过程中所发生的主要化学反应不属于氧化还原反应的是( )
| A. | 用氯气和消石灰制漂白粉 | B. | 铝热法冶炼金属铁 | ||
| C. | 用油脂制肥皂 | D. | 电解水制H2 |
12.与丁醇互为同分异构体的物质是( )
| A. | 乙醚 | B. | 甲醚 | C. | 乙醛 | D. | 乙醇 |
9.下列叙述正确的是( )
| A. | 向水中加入稀氨水,平衡逆向移动,c(OH-)降低 | |
| B. | 向水中加入少量固体硫酸氢钠,c(H+)增大,Kw不变 | |
| C. | 向水中加入少量NaOH,平衡逆向移动,c(H+)降低 | |
| D. | 将水加热,Kw增大,pH不变 |
 已知一定温度和压强下,在起始容积为V L的容器中充入1mol A和1mol B,保持恒温恒压下反应:A(g)+B(g)?C(g)△H>0.达到平衡时,C的体积分数为40%.试回答:
已知一定温度和压强下,在起始容积为V L的容器中充入1mol A和1mol B,保持恒温恒压下反应:A(g)+B(g)?C(g)△H>0.达到平衡时,C的体积分数为40%.试回答: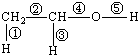 (1)乙醇的分子结构如图:其中①②③④⑤表示化学键的代号,用代号回答:
(1)乙醇的分子结构如图:其中①②③④⑤表示化学键的代号,用代号回答: