题目内容
10.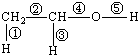 (1)乙醇的分子结构如图:其中①②③④⑤表示化学键的代号,用代号回答:
(1)乙醇的分子结构如图:其中①②③④⑤表示化学键的代号,用代号回答:①乙醇与钠反应断裂的键是⑤
②乙醇与氧气在铜或银作催化剂,加热条件下反应断裂的键是③⑤
③乙醇与浓硫酸混合加热到170℃时反应断裂的键是⑤
(2)把一端弯成螺旋状的铜丝放在酒精灯外焰部分加热,看到铜丝表面变成黑色.趁热将它反复插入盛乙醇的试管中,铜丝表面又变成红色,并有刺激性气味的物质生成,总反应的化学方程式2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O.
分析 (1)乙醇含有-OH,可发生取代、消去、氧化等反应,反应条件不同,生成物不同,化学键断裂的方式不同,当发生酯化反应时,⑤断裂,发生取代反应时,⑤键断裂,发生消去反应时,①④断裂,发生催化氧化时③⑤断裂;
(2)金属铜在乙醇氧化生成乙醛的反应中作催化剂,螺旋状的铜丝放在酒精灯外焰部分加热,铜被氧气氧化为黑色氧化铜,氧化铜能将乙醇氧化为乙醛,自身被还原成铜.
解答 解:①乙醇与与金属钠反应生成乙醇钠和氢气,断开的羟基上的氢氧键,即⑤断裂;
故答案为:⑤;
②乙醇在铜或银作催化下与O2反应生成乙醛和水,断开的是羟基上的氢氧键和与羟基所连的碳的氢,即③⑤断裂;
故答案为:③⑤;
③乙醇与浓硫酸混合加热到170℃时发生酯化反应,反应断裂的键是⑤,故答案为:⑤;
(2)把一端弯成螺旋状的铜丝放在酒精灯外焰部分加热,铜被氧气氧化为黑色CuO,立即将它插入盛乙醇的试管,
氧化铜能将乙醇氧化为乙醛,同时由黑色氧化铜又变成红色铜,试管中有刺激性气味的乙醛生成,金属铜在反应中作催化剂,反应的方程式为:2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O;
故答案为:黑;红;刺激性;2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O.
点评 本题考查有机物的结构和性质,题目难度不大,注意把握有机物的结构特点和反应类型,尤其是共价键的断裂方式,为解答该题的侧重点,答题时注意体会.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
20.下列溶液中各微粒的浓度关系正确的是( )
| A. | 0.1mol﹒L-1CH3COOH溶液中:c(CH3COO-)+c(OH-)=c(H+) | |
| B. | 0.1mol﹒L-1CuSO4溶液中:c(SO42-)>c(Cu2+)>c(OH-)>c(H+) | |
| C. | 室温下,pH=2的HCl溶液与pH=12的氨水等体积混合后的溶液中:c(Cl-)>c(NH4+) | |
| D. | 物质的量浓度相同的HCl溶液与氨水等体积混合后的溶液中:c(Cl-)=c(NH4+) |
1.分子式为C8H10的芳香烃,其一氯代物的种类数是( )
| A. | 9 | B. | 12 | C. | 14 | D. | 16 |
18.一种燃料电池,一极通入空气,另一极通入丁烷(C4H10)气体;电解质是掺杂氧化钇(Y2O3)的氧化锆(ZrO2)晶体,在熔融状态下能传导O2-.下列对该燃料说法正确的是( )
| A. | 在熔融电解质中,O2-由负极移向正极 | |
| B. | 放电时每转移4 mol电子,正极有1mol O2被氧化 | |
| C. | 通入空气的一极是正极,电极反应为:O2+4e-=2O2- | |
| D. | 通入丁烷的一极是正极,电极反应为:C4H10+26e-+13O2=4CO2+5H2O |
5.下列物质分子中,所有原子都处于同一平面内的是( )
| A. | CH4 | B. | C6H6 | C. | CH3-CH3 | D. | CH3Cl |
15.下列描述正确的是( )
| A. | 向浓氨水中滴加饱和FeCl3溶液,可以制得Fe(OH)3胶体 | |
| B. | 为除去Mg(OH)2固体中少量Ca(OH)2,可用饱和MgCl2溶液多次洗涤后,再水洗、干燥 | |
| C. | 向溶液X中加入足量盐酸,产生无色无味气体,将气体通入澄清石灰水,产生白色沉淀,说明溶液X中含有CO32- | |
| D. | 验证炭与浓硫酸反应产生的CO2,将炭与浓硫酸反应生成的气体通入盛有澄清石灰水的试管中,观察是否有白色沉淀生成 |
19.下列物质中不能使溴水褪色的是( )
| A. | 甲苯 | B. | 苯乙烯 | C. | 丙炔 | D. | 乙醛 |
20.下列说法正确的是( )
| A. | 1mol甲烷(CH4)分子中所含电子数为9NA | |
| B. | 24g镁原子的最外层电子数为NA | |
| C. | 在标准状况下,1 mol H2和1mol H2O所占的体积都约是22.4L | |
| D. | 在标准状况下,22.4L由N2和N2O组成的混合气体中,所含有的氮原子的物质的量2mol |