题目内容
(1)8g液态的CH3OH在氧气中完全燃烧,生成二氧化碳气体和液态水时释放出Q kJ的热量.试写出液态CH3OH燃烧热的热化学方程式 .
(2)在化学反应过程中,破坏旧化学键需要吸收能量,形成新化学键又会释放能量.
已知反应N2+3H2═2NH3△H=a KJ/mol.
试根据表中所列键能数据计算a的数值为: .
(3)已知:C(s,石墨)+O2(g)═CO2(g)△H1=-393.5kJ/mol
2H2(g)+O2(g)═2H2O(l)△H2=-571.6kJ/mol
2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l)△H3=-2599kJ/mol
根据盖斯定律,由C(s,石墨)和H2(g)生成1mol C2H2(g)反应的热化学方程式: .
(2)在化学反应过程中,破坏旧化学键需要吸收能量,形成新化学键又会释放能量.
| 化学键 | H-H | N-H | N≡N |
| 键能/kJ?mol-1 | 436 | 391 | 945 |
试根据表中所列键能数据计算a的数值为:
(3)已知:C(s,石墨)+O2(g)═CO2(g)△H1=-393.5kJ/mol
2H2(g)+O2(g)═2H2O(l)△H2=-571.6kJ/mol
2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l)△H3=-2599kJ/mol
根据盖斯定律,由C(s,石墨)和H2(g)生成1mol C2H2(g)反应的热化学方程式:
考点:反应热和焓变,热化学方程式
专题:化学反应中的能量变化
分析:(1)根据热化学方程式的书写方法可知,化学计量数与反应热成正比,并注意标明物质的聚集状态,根据燃烧热的概念结合热化学方程式的书写来回答;
(2)根据反应热等于反应物的总键能-生成物的总键能求算;
(3)据已知热反应方程式,根据盖斯定律解答.
(2)根据反应热等于反应物的总键能-生成物的总键能求算;
(3)据已知热反应方程式,根据盖斯定律解答.
解答:
解:(1)8gCH3OH在氧气中燃烧生成CO2和液态水,放出QkJ热量,64g即2molCH3OH在氧气中燃烧生成CO2和液态水,放出8QkJ热量,
则燃烧热的热化学方程式为:CH3OH(g)+
O2(g)═CO2(g)+2H2O(l)△H=-4QKJ/mol,
故答案为:CH3OH(g)+
O2(g)═CO2(g)+2H2O(l)△H=-4QKJ/mol;
(2)N2(g)+3H2(g)???2NH3(g)△H=945kJ?mol-1+436kJ?mol-1×3-391kJ?mol-1×6=-93kJ?mol-1=a kJ?mol-1,因此a=-93,
故答案为:-93;
(3)已知:①C(s,石墨)+O2(g)═CO2(g)△H1=-393.5kJ/mol
②2H2(g)+O2(g)═2H2O(l)△H2=-571.6kJ/mol
③2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l)△H3=-2599kJ/mol
据盖斯定律,(①×4+②-③)÷2得:2C(s,石墨)+H2(g)=C2H2(g)△H=+226.7KJ/mol,
故答案为:2C(s,石墨)+H2(g)=C2H2(g)△H=+226.7KJ/mol.
则燃烧热的热化学方程式为:CH3OH(g)+
| 3 |
| 2 |
故答案为:CH3OH(g)+
| 3 |
| 2 |
(2)N2(g)+3H2(g)???2NH3(g)△H=945kJ?mol-1+436kJ?mol-1×3-391kJ?mol-1×6=-93kJ?mol-1=a kJ?mol-1,因此a=-93,
故答案为:-93;
(3)已知:①C(s,石墨)+O2(g)═CO2(g)△H1=-393.5kJ/mol
②2H2(g)+O2(g)═2H2O(l)△H2=-571.6kJ/mol
③2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l)△H3=-2599kJ/mol
据盖斯定律,(①×4+②-③)÷2得:2C(s,石墨)+H2(g)=C2H2(g)△H=+226.7KJ/mol,
故答案为:2C(s,石墨)+H2(g)=C2H2(g)△H=+226.7KJ/mol.
点评:本题考查学生热化学方程式的书写方面的知识,注意反应热等于反应物的总键能-生成物的总键能的应用.

练习册系列答案
相关题目
已知反应4A(g)?2B(g)+E(g)△H>0.达到平衡时,要使正反应速率降低,A的浓度增大,可以采取的措施是( )
| A、增大压强 | B、减小压强 |
| C、减少E的浓度 | D、降温 |
高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压.高铁电池的总反应为下列叙述不正确的是( )3Zn+2K2FeO4+5H2O
3zs(OH)2+2Fe(OH)3+4KOH.
| 放电 |
| 充电 |
| A、放电时负极反应为:Zn+2OH--2e-═Zn(OH)2 |
| B、充电时阳极反应为:Fe(OH)3+5OH--3e-═FeO42-+4H2O |
| C、放电时每转移3mol电子,正极有1mol K2FeO4被氧化 |
| D、放电时正极附近溶液的碱性增强 |
1mol气态钠离子和1mol气态氯离子结合生成1mol氯化钠晶体释放出的热能为氯化钠晶体的晶格能.下列热化学方程式中,能直接表示出氯化钠晶体晶格能的是( )
| A、Na+(g)+Cl-(g)═NaCl(s)△H |
| B、Na(s)+12Cl2(g)═NaCl(s)△H1 |
| C、Na(g)-e-═Na+(g)△H2 |
| D、Cl(g)+e-═Cl-(g)△H3 |
对于放热反应2H2+O2
2H2O,下列说法中正确的是( )
| ||
| A、产物H2O所具有的总能量高于反应物H2和O2所具有的总能量 |
| B、反应物H2和O2所具有的总能量高于产物H2O所具有的总能量 |
| C、反应物H2和O2所具有的总能量等于产物H2O所具有的总能量 |
| D、反应物H2和O2具有的能量相等 |
下列离子方程式正确的是( )
| A、将少量石灰水滴入碳酸氢钠溶液中 HCO3-+Ca2++OH-═CaCO3↓+H2O | ||||
B、碳酸氢铵与足量氢氧化钠两种浓溶液混合加热 NH4++OH-
| ||||
| C、用惰性电极电解氯化钠溶液 2H2O+2Cl-═Cl2↑+H2↑+2OH- | ||||
| D、亚硝酸钠水溶液显碱性 NO2-+H2O?HNO2+OH- |
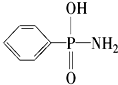 ,在P-N键中,你认为共用电子对偏向
,在P-N键中,你认为共用电子对偏向