题目内容
9.一定条件下,在体积一定的密闭容器中加入1mol N2和3mol H2发生反应:N2+3H2 $?_{催化剂}^{高温高压}$2NH3(正反应是放热反应).下列有关说法正确的是( )| A. | 达到化学反应限度时,可生成2mol NH3 | |
| B. | 向容器中再加入N2,可以加快反应速率 | |
| C. | 降低温度可以加快反应速率 | |
| D. | 1mol N2 和3mol H2的总能量低于2mol NH3的总能量 |
分析 A.可逆反应的反应物不能完全转化;
B.增大浓度,反应速率加快;
C.降温化学反应速率减慢;
D、反应放热,说明反应物能量高于生成物.
解答 解:A.合成氨是可逆反应,可逆反应的反应物不能完全转化为生成物,所以1mol N2和3mol H2发生反应生成的氨气少于2mol,故A错误;
B.增大浓度,反应速率加快,在体积一定的密闭容器中再加入 N2反应速率加快,故B正确;
C.降低温度,化学反应速率会减慢,故C错误;
D.反应放热,说明1mol N2和3mol H2的总能量高于2mol NH3的总能量,故D错误;
故选B.
点评 本题考查了影响化学反应速率的因素、可逆反应的特点、反应焓变与反应物生成物能量关系,题目难度不大,明确化学反应速率及其影响因素为解答关键,注意明确可逆反应特点,试题培养了学生的灵活应用能力.

练习册系列答案
相关题目
3.将8.0克Fe和CuO的混合物投入300mL 2mol/L硝酸中,反应完全后生成2.24LNO(标准状况下测得),再向反应后的溶液中加入2mol/L NaOH溶液,要使所有金属元素完全沉淀下来,所加入NaOH溶液的体积最少需要( )
| A. | 250mL | B. | 200 mL | C. | 100 mL | D. | 不能确定 |
20.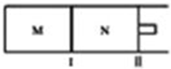 如图所示,隔板I固定不动,活塞II可自由移动,M、N两个容器中均发生反应:A(g)+2B(g)?xC(g),向M、N中通入1mol和2molB的混合气体,初始M、N容积相同,保持温度不变.下列说法正确的是( )
如图所示,隔板I固定不动,活塞II可自由移动,M、N两个容器中均发生反应:A(g)+2B(g)?xC(g),向M、N中通入1mol和2molB的混合气体,初始M、N容积相同,保持温度不变.下列说法正确的是( )
 如图所示,隔板I固定不动,活塞II可自由移动,M、N两个容器中均发生反应:A(g)+2B(g)?xC(g),向M、N中通入1mol和2molB的混合气体,初始M、N容积相同,保持温度不变.下列说法正确的是( )
如图所示,隔板I固定不动,活塞II可自由移动,M、N两个容器中均发生反应:A(g)+2B(g)?xC(g),向M、N中通入1mol和2molB的混合气体,初始M、N容积相同,保持温度不变.下列说法正确的是( )| A. | 若x=3,达到平衡后A的体积分数关系为:φ(M)>φ(N) | |
| B. | 若x<3,C的平衡浓度关系为:c(M)<c(N) | |
| C. | 若x>3,达到平衡后B的转化率关系为:α(M)>α(N) | |
| D. | x不论为何值,平衡时M、N中的平均相对分子质量都相等 |
17.下列化学用语书写正确的是( )
| A. | NH4Cl的电子式: | |
| B. | HClO的结构式为:H-Cl-O | |
| C. | 氯化镁的电子式: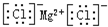 | |
| D. | 用电子式表示氯化氢分子的形成过程: |
4.下列各组物质的晶体中,化学键类型和晶体类型均相同的是( )
| A. | NH3和NH4Cl | B. | HCl和SiO2 | C. | CO2和H2O | D. | KCl和K |
14.氢气是人类最理想的能源.已知在25℃、101 kPa下,1 g氢气完全燃烧生成液态水时放出热量142.9 kJ,则下列热化学方程式书写正确的是( )
| A. | 2H2+O2═2H2O△H=-571.6 kJ/mol | B. | H2(g)+$\frac{1}{2}$O2(g)═H2O(g )△H=-285.8kJ/mol | ||
| C. | 2H2(g)+O2(g)═2H2O(l)△H=-571.6 kJ/mol | D. | 2H2(g)+O2(g)═2H2O(l)△H=+571.6 kJ/mol |
1.下列实验操作和结论正确的是( )
| A. | 用新制Cu(0H)2悬浊液不能鉴别麦芽糖和蔗糖 | |
| B. | 硫酸铵和醋酸铅溶液均可使鸡蛋清溶液中的蛋白质变性 | |
| C. | 油是不饱和高级脂肪酸的简单甘油酯,是纯净物 | |
| D. | 用银镜反应可证明蔗糖是否转化为葡萄糖,但不能证明是否完全转化 |
18.下列叙述中,错误的是( )
| A. | 苯与浓硝酸、浓硫酸水浴加热并保持55~60℃反应生成硝基苯 | |
| B. | 乙醇在浓硫酸作催化剂和脱水剂且加热至170℃时发生消去反应生成乙烯 | |
| C. | 溴乙烷在氢氧化钠醇溶液中加热发生消去反应生成乙烯 | |
| D. | 甲苯与氯气在光照下反应主要生成2,4二氯甲苯 |
19.某可逆反应当正反应速率增大时,下列说法正确的是( )
| A. | 逆反应速率一定增大 | B. | 该反应的条件一定发生变化 | ||
| C. | 反应物的转化率一定增大 | D. | 平衡一定向正反应方向进行 |